题目内容
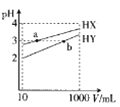
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。室温下向10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液。如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
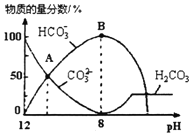
A.A点所示溶液的c(H+)=5.6×10-11
B.B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L
C.A点→B点发生反应的离子方程式为CO32-+H+=HCO3-
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
【答案】B
【解析】
A.A点c(HCO3-)=c(CO32-),Ka2=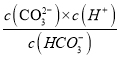 =5.6×10-11,则c(H+)=5.6×10-11mol/L,故A正确;
=5.6×10-11,则c(H+)=5.6×10-11mol/L,故A正确;
B.室温下向10mL 0.1mo1L-1Na2CO3溶液中逐滴加入0.1mo1L-1HCl溶液,B点溶液中钠离子的物质的量浓度是含碳粒子的浓度的2倍,即c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.A点→B:CO32-逐渐减少,HCO3-逐渐增加,所以发生反应的离子方程式为CO32-+H+═HCO3-,故C正确;
D.Na2CO3溶液中逐滴加入HCl,用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂滴定时NaHCO3与HCl反应产物是H2CO3,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成,故D正确;
故答案为B。

练习册系列答案
相关题目