题目内容
7. 某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )| A. | 12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | A的消耗反应速率等于B的消耗反应速率 | |
| C. | 第12s后,平衡体系的温度逐渐下降 | |
| D. | 12s内,A和B反应放出的热量为0.4Q kJ |
分析 由图象可知12s时A的浓度变化为0.8mol/L-0.2mol/L=0.6mol/L,则生成C的物质的量浓度为0.6mol/L×$\frac{4}{3}$=0.8mol/L,
A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=$\frac{△c}{△t}$;
B.图象分析计算B的反应速率,浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,速率之比等于化学方程式计量数之比;
C.12s时达到平衡时,体系温度最高,然后温度逐渐降低;
D.12s内反应3molA放热QKJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算分析.
解答 解:A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=$\frac{△c}{△t}$=$\frac{0.6mol/L}{12s}$=0.05mol/(L•s),故A错误;
B.由图象可知12s时,A的浓度变化为0.6mol/L,而B的浓度变为0.2mol/L,则速率之比为3:1,故B错误;
C.12s时达到平衡时,体系温度最高,在体积不绝热的情况下,与环境发生热交换,可使温度逐渐降低,故C正确;
D.12s内反应3molA放热QKJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算,3A(g)+B (g)?2C(g)△H=-Q kJ•mol-1,1.2molA反应放出热量0.4QKJ,故D正确.
故选CD.
点评 本题考查化学平衡问题,为高频考点,侧重考查学生的分析能力和计算能力,注意把握图象曲线的变化,把握分析问题的角度,难度中等,易错点为C,一般来说,对于放热反应,平衡时的温度为最高温度.

 优翼小帮手同步口算系列答案
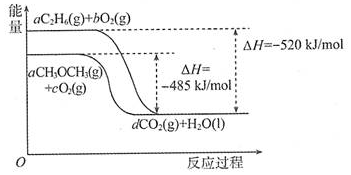
优翼小帮手同步口算系列答案| A. | 前者大于后者 | B. | 前者小于后者 | ||
| C. | 两者相等 | D. | 没有相关燃烧热数据,无法对比 |
 我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )| A. | 叶绿素属于高分子化合物 | |
| B. | 在一定条件下,叶绿素能发生加成、水解、酯化等反应 | |
| C. | 叶绿素分子中含有两种类型的双键 | |
| D. | 叶绿素中Mg2+与四个N之间结合方式不完全相同 |
请完成以下实验设计表,并在实验目的一栏中填空:
| 实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究固体物质的表面积对反应速率的影响 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
(1)达平衡时B的转化率为20%.
(2)x的值为4.
(3)若温度不变,达平衡时容器内气体的压强是反应前的1.2倍.
| 编号 | A | B | C |
| 发生装置 |  |  |  |
(a)用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
(2)标出电子转移的方向和数目,
(3)反应中Cl元素被氧化,KMnO4是氧化剂,
(4)当有1mol电子转移时,可生成气体11.2L(标准状况下)
(b)用浓盐酸和二氧化锰制氯气是实验宣更加常用的方法
(5)实验室用该方法制氯气时,可选用的发生装置是C(写编号),
(6)写出该反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
(7)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
| A. | 溴水 | B. | 稀硫酸 | C. | NaOH溶液 | D. | 浓盐酸 |
| A. | K2O2 | B. | RbHCO3 | C. | Na2O | D. | LiOH |