题目内容
2.乙烷、二甲醚的燃烧热较大,可用作燃料,图是乙烷、二甲醚燃烧过程的能量变化图.请回答下列问题.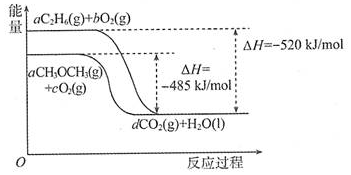
(1)乙烷的燃烧热△H=-1560kJ/mol.
(2)等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量少(填“多”或“少”).
(3)根据图写出二甲醚燃烧的热化学方程式:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1.
(4)二氧化碳是主要的温室气体,从环保角度分析,放出相同的热量时选择乙烷(填“乙烷”或“二甲醚”)作为燃料产生的CO2较少.
分析 (1)依据原子守恒分析可知氢原子守恒,6a=2,a=$\frac{1}{3}$,则根据图象分析可知 $\frac{1}{3}$mol乙烷完全燃烧放热520KJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560KJ;
(2)依据液态乙烷转化为气态乙烷要吸热分析;
(3)根据图象分析可知$\frac{1}{3}$mol二甲醚完全燃烧放热485KJ,结合热化学方程式书写方法标注物质聚集状态和对应反应的焓变写出;
(4)根据图象可知,消耗相同物质的量的乙烷和二甲醚生成的二氧化碳相同,但放出的热量乙烷多.
解答 解:(1)依据原子守恒分析可知氢原子守恒,6a=2,a=$\frac{1}{3}$,则根据图象分析可知 $\frac{1}{3}$mol乙烷完全燃烧放热520KJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560KJ,则乙烷的燃烧热△H=-1560kJ.mol-1,故答案为:-1560;
(2)因为液态乙烷转化为气态乙烷要吸热,所以等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量少,故答案为:少;
(3)根据图象分析可知$\frac{1}{3}$mol二甲醚完全燃烧放热485KJ,则1mol二甲醚完全燃烧放热=485KJ×3=1455KJ,反应的热化学方程式为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455 kJ•mol-1,
故答案为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455 kJ•mol-1;
(4)根据图象可知,消耗相同物质的量的乙烷和二甲醚生成的二氧化碳相同,但放出的热量乙烷多,所以放出相同的热量时,选择乙烷作为燃料产生的CO2较少,故答案为:乙烷.
点评 本题考查了热化学方程式书写方法,反应焓变的计算应用,图象分析判断,为高频考点,侧重考查学生的分析能力和计算能力,注意从质量守恒的角度分析,题目难度不大.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 分子数不同 | B. | 质子数相同 | C. | 氧原子数相同 | D. | 气体质量相同 |
| A. | 用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. |  | B. |  | C. |  | D. |  |
| M | N | ||
| X | Y |
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
 某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )| A. | 12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | A的消耗反应速率等于B的消耗反应速率 | |
| C. | 第12s后,平衡体系的温度逐渐下降 | |
| D. | 12s内,A和B反应放出的热量为0.4Q kJ |
| A | B | C | D | |
| 反应 装置或 图象 |  |  |  |  |
| 实验现 象或图 像信息 | 反应开始 后,针筒活 塞向右移动 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 温度计的 水银柱不 断上升 |
| A. | A | B. | B | C. | C | D. | D |