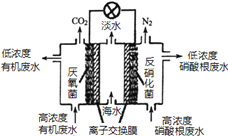
题目内容
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
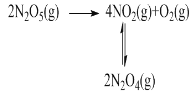
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
【答案】30 ![]() 大于
大于 ![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大 13.4
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大 13.4
【解析】
②根据阿伏加德罗定律可知,在恒温恒容条件下,气体的压强与物质的量成正比;
③根据温度对压强和平衡状态的影响分析;
④根据五氧化二氮完全分解时的压强计算出二氧化氮、氧气的压强,然后再根据二氧化氮转化的方程式计算平衡时二氧化氮、四氧化二氮的压强;
②在恒容容器中,气体的分压和物质的量成正比,故此题中可用P代替各物质的量使用。t=62min时,![]() =2.9 kPa,因此
=2.9 kPa,因此![]() =(35.8-2×2.9)kPa=30.0 kPa,
=(35.8-2×2.9)kPa=30.0 kPa, ![]() ,故答案为:30;
,故答案为:30;![]() ;
;
③根据pV=nRT,恒容容器中,升高温度,T增大,所以总压强P增大。![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,因此总压强大于63.1kPa,故答案为:大于;
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,因此总压强大于63.1kPa,故答案为:大于;![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大;
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大;
④根据题中63.1kPa数值,![]() ,所以
,所以![]() 。根据反应前后氮原子守恒可知:
。根据反应前后氮原子守恒可知:![]() ,解得
,解得![]() ,
,![]() ,
, 。故答案为13.4。
。故答案为13.4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案