题目内容
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
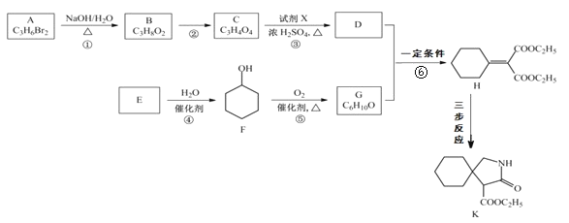
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
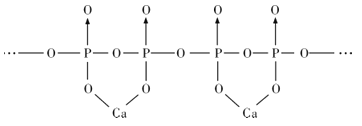
由图推知该多磷酸钙盐的通式为__。
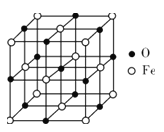
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
【答案】球形 大 磷原子的3p轨道半充满,较稳定 K2[Fe(SCN)5] sp3 sp 正四面体  或
或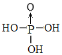 (CaP2O6)n 6
(CaP2O6)n 6 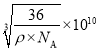
【解析】
(1)锂是3号元素,基态锂原子核外能量最高的电子位于2s轨道;基态磷原子3p轨道上电子半充满,电子的能量低,第一电离能反常。
(2) FeCl3与KSCN溶液混合,可得到配位数为5的配离子为[Fe(SCN)5]2-,再依据电荷守恒,配上2个K+,从而得出其化学式,依据其中硫、碳的价层电子对数,确定杂化类型。
(3) PO43-的空间构型为AB4型结构;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3为二元酸,分子中含有2个-OH,由此写出结构式。
(4)由图找出结构单元,从而推知该多磷酸钙盐的通式。
(5)从晶胞中找到位于中心的一个O2-,然后寻找等距离的Fe2+数目。可从一个小立方体中进行计算,在小立方体中,含有![]() 个“FeO”,则由密度可计算其体积,从而求出Fe2+与O2-最短核间距。
个“FeO”,则由密度可计算其体积,从而求出Fe2+与O2-最短核间距。
(1)基态锂原子核外能量最高的电子所在的电子云为2s,其轮廓图形状为球形;基态磷原子价电子排布为3s23p3,P轨道电子半充满,能量低,第一电离能出现反常,所以比基态硫的大,原因是磷原子的3p轨道半充满,较稳定。答案为:球形;大;磷原子的3p轨道半充满,较稳定;
(2) FeCl3与KSCN溶液混合,可得到配位数为5的配离子为[Fe(SCN)5]2-,再依据电荷守恒,配上2个K+,从而得出其化学式K2[Fe(SCN)5],其中硫、碳的价层电子对数分别为4、2,杂化类型分别是sp3、sp。答案为:K2[Fe(SCN)5];sp3;sp;
(3) PO43-的结构式中,P原子周围有4个O原子,构成AB4型结构,所以空间构型为正四面体;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3为二元酸,分子中含有2个-OH,从而得出H3PO3的结构式为 或
或 。答案为:正四面体;
。答案为:正四面体; 或
或 ;
;
(4)由图推知,其结构单元为 ,该多磷酸钙盐的通式为(CaP2O6)n。答案为:
,该多磷酸钙盐的通式为(CaP2O6)n。答案为: ;
;
(5)从晶胞中找到位于中心的一个O2-,在其周围等距离的Fe2+数目为6。可从一个小立方体中进行计算,在小立方体中,含有![]() 个“FeO”,设Fe2+与O2-最短核间距为a,则a3=
个“FeO”,设Fe2+与O2-最短核间距为a,则a3=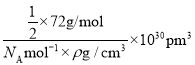 ,从而求出a=
,从而求出a=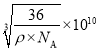 。答案为:
。答案为: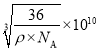 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案