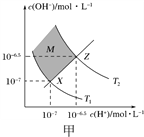
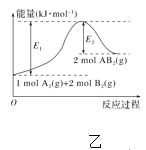
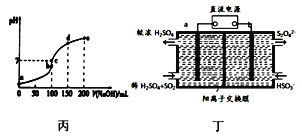
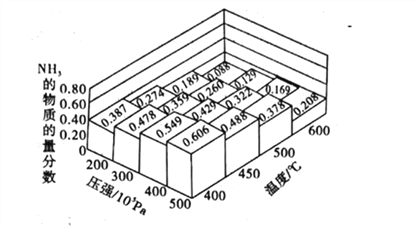
题目内容
【题目】下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+OH-
Cl2↑+H2↑+OH-
B. 碳酸氢钠溶液与过量澄清石灰反应:HCO3-+Ca2++OH-= CaCO3↓+ H2O
C. NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O
D. 向明矾溶液中滴加过量氨水:Al3++4NH3![]() H2O=Al02-+4NH4++2H2O
H2O=Al02-+4NH4++2H2O
【答案】B
【解析】
A、氢氧化镁为沉淀,不能拆,故离子方程式为:Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2,故A错误;
Cl2↑+H2↑+Mg(OH)2,故A错误;
B、碳酸氢钠溶液与过量澄清石灰反应,则碳酸氢钠为少量,该反应的离子反应为:HCO3-+Ca2++OH-= CaCO3↓+ H2O,故B正确;
C、质量和电荷不守恒,应该为:H++S042-+Ba2++ OH-= BaS04↓+H2O,故C错误;
D、向明矾溶液中滴加过量氨水生成氢氧化铝和铵根离子,离子反应为Al3++3NH3![]() H2O=Al(OH)3+3NH4+,故D错误;
H2O=Al(OH)3+3NH4+,故D错误;
综上所述,本题应选B。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。