题目内容
15. (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)①金刚石(C-C)②锗(Ge-Ge)③晶体硅(Si-Si)④金刚砂(Si-C)
(2)某晶体的晶胞如图1所示,X位于体心,Y位于6个面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为1:2:1;
(3)某元素的基态原子的电子排布式为1s22s22p63s23p4,元素符号为S;则元素原子的轨道表示式
 .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.(4)德、美科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图2),C20晶体属于分子晶体 (填晶体类型).
分析 (1)这几种物质都是原子晶体,原子晶体熔沸点与键长成反比;
(2)该晶胞中X粒子个数是1、Y粒子个数=4×$\frac{1}{2}$、Z粒子个数=8×$\frac{1}{8}$,据此计算X、Y、Z粒子个数之比;
(3)根据原子核外电子排布式知,该原子核外电子数为16,原子中原子序数=核外电子数,其最高价氧化物的水化物是硫酸;
(4)分子晶体的构成微粒是分子,根据晶体构成微粒确定晶体类型.
解答 解:(1)这几种物质都是原子晶体,原子晶体熔沸点与键长成反比,键长:Ge-Ge>Si-Si>Si-C>C-C,所以晶体熔沸点金刚石>金刚砂>晶体硅>锗,故答案为:①>④>③>②;
(2)该晶胞中X粒子个数是1、Y粒子个数=4×$\frac{1}{2}$=2、Z粒子个数=8×$\frac{1}{8}$=1,所以X、Y、Z粒子个数之比=1:2:1,故答案为:1:2:1;
(3)根据原子核外电子排布式知,该原子核外电子数为16,所以该元素是S,原子中原子序数=核外电子数,S原子核外电子轨道表示式为 ,其最高价氧化物的水化物化学式为H2SO4,
,其最高价氧化物的水化物化学式为H2SO4,
故答案为:S; ;H2SO4;
;H2SO4;
(4)分子晶体的构成微粒是分子,该晶体是由C20分子构成的,所以属于分子晶体,故答案为:分子晶体.
点评 本题考查晶胞计算、核外电子排布、晶体类型判断、晶体熔沸点比较等知识点,为高考高频点,知道晶体熔沸点影响因素、常见晶体类型,难点是晶胞计算,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
5.下列装置属于原电池的是( )
| A. | 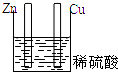 | B. | 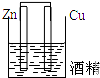 | C. | 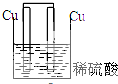 | D. | 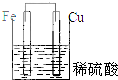 |
6.将足量CO2通入下列溶液中,一定能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 氯化钡溶液 | D. | 氯化钙溶液 |
3.用水稀释0.1mol•L-1氨水时,溶液中随水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | C. | n(OH-)和c(H+) | D. | c(H+)和c(OH-)的乘积 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
20.下列说法正确的是( )
| A. |  如图可表示水分解过程中的能量变化 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ: 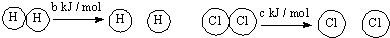 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c |
7.如图为元素周期表截取的短周期的一部分,即 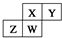 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |