题目内容
【题目】
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
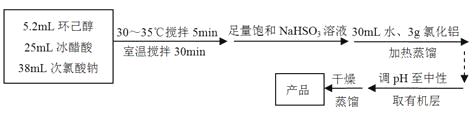
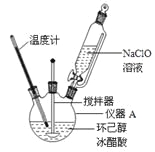
主反应:
回答下列问题:
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
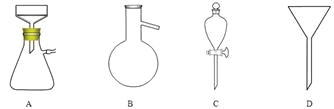
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
【答案】⑴三颈烧瓶(1分) ⑵ 搅拌器搅拌(1分);缓慢滴加NaClO溶液。(1分)
⑶ ClO-+ HSO3-="=" Cl-+ H++ SO42-(2分)用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量。(2分,其他合理答案也给分。)
⑷ BD (2分,每项1分,多答不得分)
⑸ 降低环己酮的溶解度,有利于环己酮分层 。(2分); C (1分)
⑹ 1.800mol/L (2分,有效数字不正确得1分,单位不写不得分)
【解析】试题分析:(1)根据仪器A的构造知其名称是三颈烧瓶;(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有搅拌器搅拌、缓慢滴加NaClO溶液;(3)饱和NaHSO3溶液和次氯酸钠溶液发生氧化还原反应生成硫酸钠和盐酸,离子方程式为ClO-+ HSO3-="=" Cl-+ H++ SO42-;加入的饱和NaHSO3溶液足量时溶液中无次氯酸钠,实验操作是用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量;(4)根据题意知,馏出液呈酸性,为将馏出液的pH调至中性,可以加入的试剂是无水碳酸钠和氢氧化钠固体,选BD;(5)调节pH后还需加入精制食盐,其目的是降低环己酮的溶解度,有利于环己酮分层,“取有机层”的基本操作是分液,使用的主要仪器是 分液漏斗,选C;(6)该实验的原理为:2H++ClO-+2I-![]() I2+Cl-+H2O、I2+2Na2S2O3==2NaI+Na2S4O6。次氯酸根和硫代硫酸钠的关系式为ClO-——2Na2S2O3,代入题给数据计算得该NaClO溶液的浓度是1.800mol/L。
I2+Cl-+H2O、I2+2Na2S2O3==2NaI+Na2S4O6。次氯酸根和硫代硫酸钠的关系式为ClO-——2Na2S2O3,代入题给数据计算得该NaClO溶液的浓度是1.800mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。用0.200mol/L的盐酸标准液滴定待测液,滴定时用酚酞做指示剂。试根据实验回答下列问题:
(1)下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视_________,本实验滴定达到终点的标志是_________________________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 ,烧碱样品的纯度是___________
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若该实验修改成“用待测碱液滴定盐酸标准液”,则下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液。
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数


