题目内容
6.将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4,下列关于NaHSO4的说法中正确( )| A. | NaHSO4固体熔化时破坏的是离子键和共价键 | |
| B. | NaHSO4固体中阳离子和阴离子的个数比是2:1 | |
| C. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 | |
| D. | 因为NaHSO4是离子化合物,因此能够导电 |
分析 NaHSO4为离子化合物,熔融时可电子出Na+、HSO4-,溶于水可电子出Na+、H+、SO42-,以此解答该题.
解答 解:A.硫酸氢钠固体熔化时电离出钠离子和硫酸氢根离子,所以只破坏离子键不破坏共价键,故A错误;
B.硫酸氢钠固体中其阴阳离子分别是硫酸氢根离子、钠离子,所以NaHSO4固体中阳离子和阴离子的个数比是1:1,故B错误;
C.硫酸氢钠溶于水时,电离出自由移动的钠离子、氢离子和硫酸根离子,所以破坏共价键和离子键,故C正确;
D.硫酸氢钠固体是由阴阳离子构成的,为离子化合物,因为硫酸氢钠固体中的阴阳离子不自由移动,所以不导电,故D错误.
故选C.
点评 本题考查了硫酸氢钠的有关知识,明确硫酸氢钠熔融状态和在水溶液里电离方式的区别是解本题关键,此点为考试热点,也是学生易错点,难度不大.

练习册系列答案
相关题目
16.几种短周期元素的原子半径及主要化合价见下表
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>X>Y | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:X>R>Y | |
| D. | 单质与氢气化合的难易程度:Z>T |
17.甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )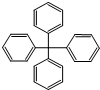

| A. | 分子式为C25H20 | |
| B. | 分子中所有原子有可能处于同一平面 | |
| C. | 该化合物分子中所有原子不可能处于同一平面 | |
| D. | 分子中处于同一平面的原子最多23个 |
14.下列实验一般需要水浴加热的是( )
| A. | 银镜反应 | B. | 制取乙酸乙酯 | C. | 乙酸乙酯水解 | D. | 乙醇的消去反应 |
1.下列实验方案能够达到目的是( )
| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将乙醇加热至170℃,制取乙烯 | |
| C. | 向试管中加入5 mL溴水、2 mL苯和0.5 g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2 mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
11.金属钛(Ti)被称为未来“钢铁”,也称为“太空金属”.对钛元素的同位素${\;}_{22}^{46}$Ti、${\;}_{22}^{47}$Ti、${\;}_{22}^{48}$Ti、${\;}_{22}^{49}$Ti、${\;}_{22}^{50}$Ti,下列说法中不正确的是( )
| A. | 上述同位素中,Ti原子核中的中子数不可能为30 | |
| B. | 题述中包括5种钛原子,即钛元素的5种核素 | |
| C. | 根据题意可求得钛元素的平均相对原子质量为48 | |
| D. | 钛元素属过渡金属元素 |
18.下列命名正确的是( )
| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4-三甲基戊烷 | D. | 2,3,3-三甲基己烷 |
15.下列判断正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2+4H+═SO42-+3S↓+2H2O | |
| B. | 用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl | |
| C. | 滴加甲基橙试液后呈红色的溶液中可以大量共存:Na+、CO32-、K+、Al3+ | |
| D. | 25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |