题目内容
7.下列图示实验正确的是( )| A. | 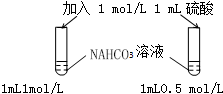 探究浓度对化学反应速率的影响 | B. | 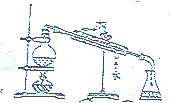 分离乙醇和乙酸的混合溶液 | ||
| C. | 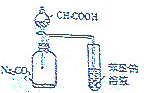 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 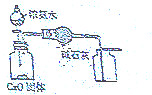 制取并且收集干燥纯净的NH3 |
分析 A.只有碳酸氢钠的浓度不同;
B.乙醇和乙酸的混合溶液不分层,沸点不同;
C.醋酸易挥发,醋酸也与苯酚钠反应生成苯酚;
D.氨气的密度比空气小,利用向下排空气法收集.
解答 解:A.只有碳酸氢钠的浓度不同,只有一个变量,则该实验可探究浓度对化学反应速率的影响,浓度大生成气体的速率快,故A正确;
B.乙醇和乙酸的混合溶液不分层,沸点不同,可利用图中蒸馏装置分离,且冷水下进上出,故B正确;
C.醋酸易挥发,醋酸也与苯酚钠反应生成苯酚,则不能比较醋酸、苯酚的酸性,故C错误;
D.氨气的密度比空气小,利用向下排空气法收集,则图中氨气的收集方法不合理,故D错误;
故选AB.
点评 本题考查化学实验方案的评价,为高频考点,涉及影响反应速率的因素、混合物分离提纯、酸性比较、气体的制备及收集等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
17.甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )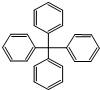

| A. | 分子式为C25H20 | |
| B. | 分子中所有原子有可能处于同一平面 | |
| C. | 该化合物分子中所有原子不可能处于同一平面 | |
| D. | 分子中处于同一平面的原子最多23个 |
18.下列命名正确的是( )
| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4-三甲基戊烷 | D. | 2,3,3-三甲基己烷 |
15.下列判断正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2+4H+═SO42-+3S↓+2H2O | |
| B. | 用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl | |
| C. | 滴加甲基橙试液后呈红色的溶液中可以大量共存:Na+、CO32-、K+、Al3+ | |
| D. | 25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
2.已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,根据化学方程式:N2+3H2 $\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3.1mol N2反应放出的热量 为92.4kJ•mol-1那么N≡N键的键能是( )
| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
12.研究小组以Ag-ASM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图,由图得出的正确结论是( )
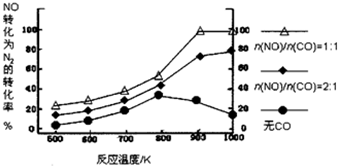

| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
19.某有机物W的分子式为C5H10O2能发生银镜反应,又能和钠反应产生气体.W的同分异构体有( )
| A. | 10种 | B. | 12种 | C. | 15种 | D. | 18种 |
6.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |