题目内容
4.0.01 mol/L H2SO4溶液和0.01 mol/L NaOH 溶液相互滴定,中和后加水稀释至100mL.若在滴定时终点有误:①多加1滴稀硫酸;②多加1滴NaOH 溶液(设每mL溶液约为20滴),则①和②两次滴定后溶液中c(H+)之比为( )| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
分析 根据多滴了1滴H2SO4,溶液呈酸性,抓住过量的H+求出c(H+),多加1滴NaOH 溶液,溶液呈碱性,抓住过量的OH-求出c(OH-),然后根据水的离子积常数求出c(H+).
解答 解:每1mL溶液约为20滴,则1滴为0.05mL,多加1滴H2SO4,溶液中C(H+)=$\frac{0.05{×10}^{-3}L×0.01mol/L×2}{0.1L}$=10-5 mol/L;多加1滴NaOH 溶液,溶液中c(OH-)=$\frac{0.05×1{0}^{-3}×0.01mol/L}{0.1L}$=5×10-6mol/L,KW=c(H+).c(OH-)=10-14,c(H+)=2×10-9mol/L,则①和②两次滴定后溶液中c(H+)之比为:10-5 mol/L:2×10-9mol/L=5×103:1,
故选C.
点评 本题主要考查了溶液中氢离子浓度的计算,题目难度不大,抓住溶液的酸碱性,即判断谁过量是解决本题的关键.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
14.下列实验一般需要水浴加热的是( )
| A. | 银镜反应 | B. | 制取乙酸乙酯 | C. | 乙酸乙酯水解 | D. | 乙醇的消去反应 |
15.下列判断正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2+4H+═SO42-+3S↓+2H2O | |
| B. | 用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl | |
| C. | 滴加甲基橙试液后呈红色的溶液中可以大量共存:Na+、CO32-、K+、Al3+ | |
| D. | 25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
12.研究小组以Ag-ASM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图,由图得出的正确结论是( )
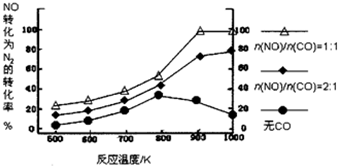

| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
19.某有机物W的分子式为C5H10O2能发生银镜反应,又能和钠反应产生气体.W的同分异构体有( )
| A. | 10种 | B. | 12种 | C. | 15种 | D. | 18种 |
2.已知某炔烃与卤素按物质的量为1:2发生加成反应,反应后,生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代,则该炔烃可能是( )
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
3.下列叙述正确的是( )
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |