题目内容
17.从海水中可以提取很多种化工原料,如图所示的是工业上对海水的几项综合利用示意图.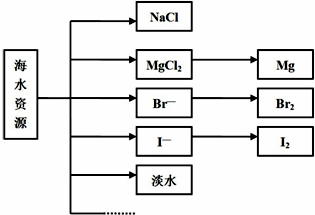
按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种.下列物质不需要通过化学变化就能够从海水中获得的是AC.
A.食盐 B.金属钠 C.淡水 D.液溴
(2)实验室以MnO2为原料制取Cl2,并通过向KBr溶液中通入氯气进行实验室中模拟海水提溴中Br-→Br2的转化.
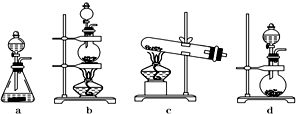
①从下列装置中选择合适的发生装置用于实验室制取少量氯气b(填写装置的序号).
②海水提溴中Br-→Br2的转化应在80~90℃,条件下进行,目的是为了溴单质形成溴蒸气蒸出
(3)海带中含有碘元素,实验室中通过将海带灼烧后检验其中的I-,主要步骤如下:
在过滤海带灰所得的滤液中滴入几滴稀硫酸,加入几滴H2O2后再滴入淀粉溶液
①写出反应的离子方程式H2O2+2H++2I-=I2+2H2O
②如何证明海带中存在碘元素在滤液中加入淀粉溶液和氯水,溶液中的碘离子与氯气反应生成碘单质,2I-+Cl2=2Cl-+I2,I2使淀粉变蓝色
(4)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁.下列气体中,镁蒸气可以在其氛围中冷却的是CE(选填下列选项的编号字母).
A.Cl2 B.N2 C.Ar D.空气 E.H2.
分析 (1)把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐;海水中得到钠,需要首先从海水中获得氯化钠,然后再去电解熔融状态的氯化钠即得钠;
(2)①根据反应物的状态和反应条件选择发生装置;
②溴单质易挥发分析;
(3)过氧化氢酸溶液中氧化碘离子生成碘单质;灼烧海带,把海带灰转入烧杯中加水溶解,然后过滤,在滤液中加入淀粉溶液和氯水,根据发生的反应分析判断;
(4)可以在其氛围中冷却镁蒸气,说明该气体与镁不反应;
解答 解:(1)把海水用蒸馏等方法可以得到淡水,是物理变化;把海水用太阳暴晒,蒸发水分后即得食盐,是物理变化;海水中得到钠,需要首先从海水中获得氯化钠,然后再去电解熔融状态的氯化钠可制得钠,是化学方法;
故选:AC;
(2)①实验室制取氯气用二氧化锰和浓盐酸,反应物是固体和液体,且需要加热,所以选择发生装置b;
故选:b;
②海水提溴中Br-→Br2的转化应在80~90℃,条件下进行,目的是为了溴单质形成溴蒸气蒸出,
故答案为:80~90℃,溴单质形成溴蒸气蒸出;
(3)①过氧化氢酸溶液中氧化碘离子生成碘单质,在过滤海带灰所得的滤液中滴入几滴稀硫酸,加入几滴H2O2后再滴入淀粉溶液,反应的离子方程式为:
H2O2+2H++2I-=I2+2H2O,
故答案为:H2O2+2H++2I-=I2+2H2O;
②检验海带中的碘元素存在,实验设计为:把海带放在坩埚中灼烧,然后把海带灰转入烧杯中加水溶解,再过滤所得悬浊液,在滤液中加入淀粉溶液和氯水,溶液中的碘离子与氯气反应生成碘单质,2I-+Cl2=2Cl-+I2,I2使淀粉变蓝色,
故答案为:在滤液中加入淀粉溶液和氯水,溶液中的碘离子与氯气反应生成碘单质,2I-+Cl2=2Cl-+I2,I2使淀粉变蓝色;
(4)能和金属镁发生反应的气体:Cl2、N2、空气,不能与金属镁发生反应的气体:Ar、H2,
故答案为:CE.
点评 本题主要考查了物质的制备与性质,物质性质分析,离子检验方法,物质制备等,难度中等,根据所学知识即可完成.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 原子半径由小到大的顺序为Y<Z<X<W | |
| B. | X的简单氢化物的热稳定性比W的强 | |
| C. | 化合物YX、ZX2、WX3,中化学键的类型相同 | |
| D. | W的最高价氧化物对应水化物的酸性比Z的弱 |
| A. | 计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品 | |
| B. | 新型能源汽车的推广有助于减少光化学烟雾的产生 | |
| C. | 2008年北京奥运会开幕式上的“脚印”等焰火主要是利用了“焰色反应”的现象 | |
| D. | 2008年我国开始实施“限塑令”,目的是限制购物塑料袋的使用,减少“白色污染” |
| A. | 10mL O2与10mL CO2含有相同的分子数 | |
| B. | 0.5 mol H2O与0.5 mol CO含有相同的分子数 | |
| C. | 同温同压下,10mL N2和10mL NO含有相同的原子数 | |
| D. | 1 mol Fe和1 mol Cu在常温下所含的原子数相同,但体积不同 |
2CO(g)+O2(g)═2CO2(g)△H 3 4Fe(s)+3O2(g)═2Fe2O3(s)△H4
Fe2O3(s)+3CO(g)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变判断不正确的是( )
| A. | △H1<0,△H3<0 | B. | △H4<0,△H2>0 | C. | 3△H3═△H4+2△H5 | D. | △H3═△H1+△H2 |
 、CO,你认为其中含量最大的是HCl.
、CO,你认为其中含量最大的是HCl.
 某实验需要100mL、0.1mol/L的Na2CO3溶液,现通过如下操作配制:
某实验需要100mL、0.1mol/L的Na2CO3溶液,现通过如下操作配制: