题目内容
6.已知:C(s)+O2(g)═CO2(g)△H1CO2(g)+C (s)═2CO(g)+H2(g)△H22CO(g)+O2(g)═2CO2(g)△H 3 4Fe(s)+3O2(g)═2Fe2O3(s)△H4
Fe2O3(s)+3CO(g)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变判断不正确的是( )
| A. | △H1<0,△H3<0 | B. | △H4<0,△H2>0 | C. | 3△H3═△H4+2△H5 | D. | △H3═△H1+△H2 |
分析 物质的燃烧反应:C(s)+O2(g)═CO2(g)△H1<0;2CO(g)+O2(g)═2CO2(g)△H3<0;4Fe(s)+3O2(g)═2Fe2O3(s)△H4<0;
单质碳作为还原剂的反应是吸热的,CO2(g)+C (s)═2CO(g)+H2(g)△H2>0,然后根据盖斯定律确定焓变的关系即可.
解答 解:物质的燃烧反应:①C(s)+O2(g)═CO2(g)△H1<0;③2CO(g)+O2(g)═2CO2(g)△H3<0;故A正确;
B、物质的燃烧反应:④4Fe(s)+3O2(g)═2Fe2O3(s)△H4<0;单质碳作为还原剂的反应是吸热的,②CO2(g)+C (s)═2CO(g)+H2(g)△H2>0,故B正确;
C、反应之间的关系:3×③=④+2×⑤,根据盖斯定律3△H3═△H4+2△H5,故C正确;
D、反应之间的关系:③=①-②,根据盖斯定律△H3═△H1-△H2,故D错误.
故选D.
点评 本题目考查学生常见的放热反应、吸热反应的焓变符号以及盖斯定律的应用知识,属于综合知识的考查,难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
14.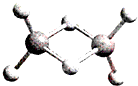 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )| A. | Al2H6在固态时所形成的晶体是分子晶体 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
1.工业生产水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.4kJ•mol-1下列判断正确的是( )
| A. | 反应物的能量总和大于生成物的能量总和 | |
| B. | 上述反应表示生成1体积CO(g)吸收131.4kJ热量 | |
| C. | 在CO(g)+H2(g)═C(s)+H2O(l) 中的△H比-131.4kJ•mol-1小 | |
| D. | C(s)+2H2O(g)═CO2(g)+2H2(g) 中的△H比+131.4kJ•mol-1小 |
18.化学与生产、生活、能源、环保等密切相关.下列有关说法正确的是( )
| A. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| B. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| D. | 绿色化学的核心是运用化学方法对环境污染进行综合治理 |

 ,请回答下列问题:
,请回答下列问题: