题目内容
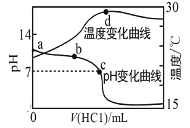
【题目】25 ℃时,用0.10 mol·L-1的氨水滴定10.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法不正确的是( )

A. 图上四点分子种类相同
B. a=0.1
C. N、Q两点的![]() :N=Q
:N=Q
D. P点溶液中存在:c(Cl-)=c(NH4+)
【答案】B
【解析】
图中四点均含有H+、NH4+ .OH-、Cl-四种离子,故A正确;B.N点溶液中存在电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(C1-),已知c(H+)=c(OH-)+c(NH3·H2O),则c(NH3·H2O) +c(NH+)=c(Cl- ),可知此时溶液中只有NH4Cl,即滴加氨水10. 80 mL.时恰好完全中和,则0.10 mol·L-1![]() 10. 80 mL= 10.00 mL
10. 80 mL= 10.00 mL![]() a mol·L-l, a=0.108,故B错误;C.
a mol·L-l, a=0.108,故B错误;C. ![]() =1/Kb, Kb(NH3·H2O)的电离平衡常数只随温度变化而变化,恒温下电离平衡常数不变,即N=Q,故C正确;D.P点滴加氨水完全反应后溶液呈中性,溶液为NH3·H2O 和NH4Cl的混合溶液,存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-),因为中性c(H+)=c(OH- ) 所以c(NH4+ )=c(Cl- ),故D正确;答案:B.。
=1/Kb, Kb(NH3·H2O)的电离平衡常数只随温度变化而变化,恒温下电离平衡常数不变,即N=Q,故C正确;D.P点滴加氨水完全反应后溶液呈中性,溶液为NH3·H2O 和NH4Cl的混合溶液,存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-),因为中性c(H+)=c(OH- ) 所以c(NH4+ )=c(Cl- ),故D正确;答案:B.。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目