题目内容
【题目】元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的价电子轨道排布图为 ______________________________ ;B的电子排布式为 _________ ;C的价电子排布式为 ____________ ;D的原子结构示意图为 __________ 。
(2)已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为 _____________,含有 _____个σ键和 _____ 个π键。
(3)B的原子核外电子运动状态________有多少种,原子轨道数为______,能级数__________,电子占据的最高能层符号为_________。
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)____________________。
【答案】![]() 1s22s22p63s23p2 3s23p5
1s22s22p63s23p2 3s23p5 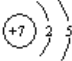
![]() 3 1 14 8 5 M HClO4 > HNO3>H2CO3 >H2SiO3
3 1 14 8 5 M HClO4 > HNO3>H2CO3 >H2SiO3
【解析】
元素A、B、C、D都是短周期元素,A元素原子的2p轨道上只有两个电子,则A的外围电子排布为2s22p2,故A为C元素;B的3p轨道上有空轨道,则B的外围电子排布为3s23p1或3s23p2,A、B同主族,故B为Si元素;B、C同周期,C是本周期中电负性最大的,故C为Cl元素;D的气态氢化物的水溶液能使无色酚酞试液变红,则D为氮元素。
(1)A为6号的C元素,基态原子电子排布式为1s22s22p2,价电子轨道排布图为 ![]() ;B为14号Si元素,电子排布式为1s22s22p63s23p2;C为17号Cl元素,基态原子电子排布式为1s22s22p63s23p5,价电子排布式为3s23p5;D为7号氮元素,原子结构示意图为
;B为14号Si元素,电子排布式为1s22s22p63s23p2;C为17号Cl元素,基态原子电子排布式为1s22s22p63s23p5,价电子排布式为3s23p5;D为7号氮元素,原子结构示意图为 ;
;
(2)D与H原子能形成一种高能量的分子N2H2,其中D原子满足8电子结构特征,则该分子的电子式为![]() ,根据结构可知,含有3个σ键和 1个π键;
,根据结构可知,含有3个σ键和 1个π键;
(3)B的电子排布式为1s22s22p63s23p2;原子核外电子运动状态有14种,原子轨道数为8,能级数5,电子占据的最高能层符号为M;
(4)元素非金属性越强其最高价氧化物的水化物的酸性越强,则四种元素最高价氧化物水化物酸性由强到弱的是HClO4 > HNO3>H2CO3 >H2SiO3。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 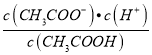
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
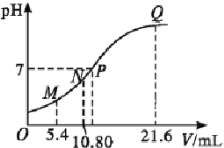
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
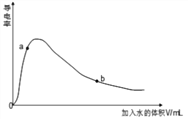
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
【题目】下表是元素周期表简化后的一部分,请用标出的元素以及对应的物质回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)写出由①和③两种元素组成的不带电的两种物质的化学式:________、_______;
(2)①~⑩号元素中最高价氧化物对应的水化物酸性最强的酸的化学式为:_______;
(3)⑩的最高价氧化物对应的水化物与⑧的最高价氧化物在加热的条件下生成盐和水的化学方程式为:___________________________________________________________;
(4)将⑤的单质通入④的常规氢化物中,反应剧烈,对应的化学方程式为:________;
(5)相同条件下⑤⑥⑦⑧四种元素的原子半径由大到小的顺序是:________________。