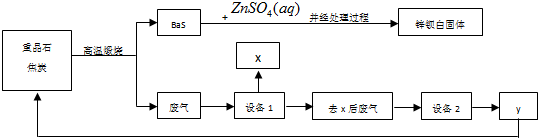
题目内容
12.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )| A. | 达到平衡后,增大压强有利于该反应平衡正向移动 | |
| B. | 达到化学平衡时,v正(A2)=2v逆(B2) | |
| C. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| D. | 达到平衡后,降低温度A2 气体的转化率减小 |
分析 A、增大压强平衡向气体体积减小的方向移动;
B、达到化学平衡时,v正(A2)=v逆(A2)=$\frac{1}{2}$v逆(B2);
C、升高温度正、逆反应速率都增大;
D、降低温度平衡向放热反应方向移动.
解答 解:A、该反应正反应是体积减小的放热反应,增大压强有利于平衡向正反应移动,故A正确;
B、达到化学平衡时,v正(A2)=v逆(A2)=$\frac{1}{2}$v逆(B2),故B错误;
C、升高温度正、逆反应速率都增大,故C错误;
D、降低温度平衡向放热反应方向移动即正反应方向移动,则气体的转化率增大,故D错误;
故选A.
点评 本题考查外界条件对化学平衡的影响,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
6.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )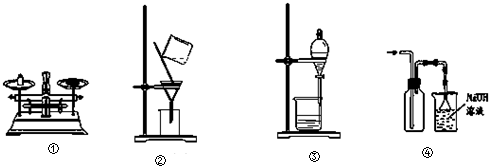

| A. | ①称量药品 | B. | ②过滤 | C. | ③分离乙醇和水 | D. | ④收集氯气 |
3. 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依据表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
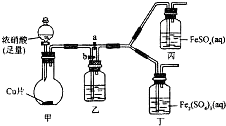
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
7.下列说法不正确的是( )
| A. | CO2,CH4,O2等均是温室效应的气体 | |
| B. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| C. | 磁共振谱可以鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
1.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-a KJ/mol 达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
2.下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 将CO2通入Na2SiO3水溶液观察是否有沉淀产生 | 探究碳和硅两元素非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
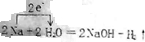 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).