题目内容
4.1836年,俄国籍瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关.按此规律,结合下述反应的热化学方程式,回答问题.已知:①NH3(g)+HCl(g)═NH4Cl(s)△H=-176kJ/mol
②NH3(g)═NH3(aq)△H=-35.1kJ/mol
③HCl(g)═HCl(aq)△H=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H=-52.3kJ/mol
⑤NH4Cl(s)═NH4Cl(aq)△H=?
则第⑤个热化学方程式中的反应热是+16.3 kJ/mol.
分析 已知:①NH3(g)+HCl═NH4Cl(s);△H=-176kJ/mol
②NH3(g)+H2O(l)═NH3(aq);△H=-35.1kJ/mol
③HCl(g)+H2O═HCl(aq);△H=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律,④-①+②+③可得:NH4Cl(s)+2H2O(l)═NH4Cl(aq),焓变也进行需要的计算.
解答 解:已知:①NH3(g)+HCl═NH4Cl(s);△H=-176kJ/mol
②NH3(g)+H2O(l)═NH3(aq);△H=-35.1kJ/mol
③HCl(g)+H2O═HCl(aq);△H=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律,④-①+②+③可得:NH4Cl(s)+2H2O(l)═NH4Cl(aq),故△H=(-52.3kJ/mol)-(-176kJ/mol)+(-35.1kJ/mol)+(-72.3kJ/mol)=+16.3kJ/mol,
故答案为:+16.3 kJ/mol.
点评 本题考查运用盖斯定律进行反应热的计算,难度中等,根据已知方程式构造目标方程式是关键.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
19.一次区分乙酸、乙醇、苯、四氯化碳四种液体的试剂是( )
| A. | H2O | B. | 溴水 | ||
| C. | 新制Cu(OH)2 | D. | 酸性高锰酸钾溶液 |
9.下列说法正确的是( )
| A. | 1 mol C5H12分子中,含17×6.02×1023个共用电子对 | |
| B. | 10 mL 18.4 mol•L-1的浓硫酸与90 mL蒸馏水混合,所得溶液中c(H+)=3.68 mol•L-1 | |
| C. | 25℃时,在pH=4的HCl溶液与pH=10的Na2CO3溶液中,水电离出的c(H+)前者大于后者 | |
| D. | 25℃时,在25 mL 0.1 mol•L-1NaOH溶液中,滴入0.1 mol•L-1的CH3COOH溶液至混合溶液pH=7时,则滴加CH3COOH溶液的体积大于25 mL |
16.某有机物的结构简式: ,该有机物不能发生的反应为( )
,该有机物不能发生的反应为( )
 ,该有机物不能发生的反应为( )
,该有机物不能发生的反应为( )| A. | 加成反应 | B. | 消去反应 | C. | 水解反应 | D. | 聚合反应 |
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
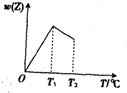 由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知: