题目内容
14.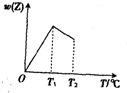 由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:(1)该化学反应的正反应方向是放热反应.
(2)T1表示该反应在时间t内可达平衡的最低(填“最高”或“最低”)温度.
(3)在T<T1的某一温度内,该反应不能(填“能”或“不能”)建立平衡.
(4)在温度T2时增大压强,达新平衡时ω(Z)将增大,则系数n的值是1,向正方向移动.
分析 (1)0-T1时间段内,随着反应的进行,Z的含量增大,T1时达到最大值,说明此点达到平衡状态,继续升高温度,Z含量降低,升高温度平衡向吸热反应方向移动;
(2)可逆反应在达到平衡状态后,每一个温度对应一个平衡状态;
(3)在T<T1的某一温度内,该反应没有达到平衡状态;
(4)在温度T2时增大压强,达新平衡时ω(Z)将增大,增大压强平衡向气体体积减小的方向移动,据此判断n及平衡移动方向.
解答 解:(1)0-T1时间段内,随着反应的进行,Z的含量增大,T1时达到最大值,说明此点达到平衡状态,升高温度平衡向吸热反应方向移动,继续升高温度,Z含量降低,则平衡逆向移动,所以正反应是放热反应,
故答案为:放;
(2)可逆反应在达到平衡状态后,每一个温度对应一个平衡状态,T1点为平衡状态点,T1后每个温度都对应一个平衡状态,此点温度最低,所以)T1表示该反应在时间t内可达平衡的最低温度,故答案为:最低;
(3)在T<T1的某一温度内,该反应没有达到平衡状态,所以在T<T1的某一温度内,该反应不能建立平衡,故答案为:不能;
(4)增大压强平衡向气体体积减小的方向移动,在温度T2时增大压强,达新平衡时ω(Z)将增大,说明平衡正向移动,则n=1,故答案为:1;正方向.
点评 本题以图象分析为载体考查化学平衡移动影响因素、平衡状态判断等知识点,正确判断平衡状态点是解本题关键,注意不能根据0-T1范围内Z含量变化确定温度对平衡移动影响,为易错点.

练习册系列答案
相关题目
4.醇在浓硫酸作用且加热条件下,醇分子间发生脱水生成醚.CH3CH2-O-CH2CH3).用浓硫酸与分子式分别为C2H6O和C3H8O的醇的混合液反应,可以得到醚的种类有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 46gNO2和N2O4的混气体中,含氮原子数目是NA | |
| B. | 1.0L 0.1mol/L的NaF溶液中,含F-离子数目是0.1NA | |
| C. | 11.2L的H2中,含有的电子数目是NA | |
| D. | 1molFeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA |
9.根据表中左栏信息,回答右栏有关问题:
| 信 息 | 问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素. | (1)X元素的最高价氧化物的电子式是 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液. | (2)Z元素在元素周期表中位于第 三周期, ⅢA族. |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成. | (3)写出生成白色沉淀的化学方程式 MgCl2+2NaOH═Mg(OH)2↓+2NaCl. |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量 的盐酸溶液,最终溶液中有白色沉淀. | (4)最终生成白色沉淀的离子方程式为 SiO32-+2H+=H2SO3↓. |
| (5)X、Y、Z、W四种元素的原子半径由大到小的顺序为 Mg>Al>Si>C(用元素符号表示) | |
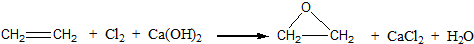


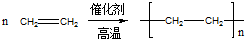 ;反应类型:加聚反应.
;反应类型:加聚反应.
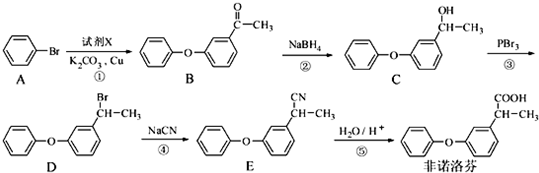
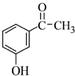 .
.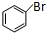 +2NaOH$\stackrel{一定条件}{→}$
+2NaOH$\stackrel{一定条件}{→}$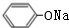 +NaBr+H2O.
+NaBr+H2O. .
.