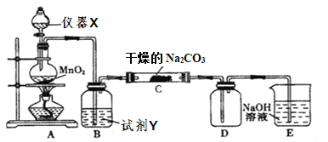
题目内容
【题目】O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.若生成2.24 L HF,则转移0.4 mol电子B.HF是氧化产物
C.O2F2既是氧化剂又是还原剂D.还原剂与氧化剂的物质的量之比为1:4
【答案】D
【解析】
该反应电子转移情况用双线桥表示为: 。
。
A. 没有说明气体所处的条件,无法用体积进行计算,A选项错误;
B. HF无元素化合价发生变化,既不是氧化产物,也不是还原产物,B选项错误;
C. O2F2中只有O化合价降低,无元素化合价升高,所以O2F2是氧化剂,但不是还原剂,C选项错误;
D. 由分析可知,S元素化合价升高,还原剂是H2S,氧化剂是O2F2,二者的物质的量之比为1:4,D选项正确;
答案选D。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A. B.
B.
C. D.
D.
【题目】CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
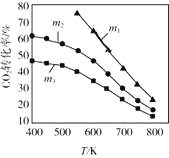
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=![]() 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大![]() 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。