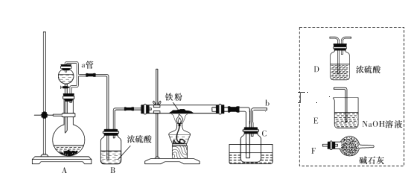
题目内容
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A.CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L1]:c(Na+)=c(CH3COO)>c(CH3COOH)>c(H+)=c(OH)
B.20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7:c(CH3COOH)=c(Cl)
C.0.1 mol·L1 CH3COOH溶液与0.1 mol·L1 Na2CO3溶液等体积混合(无气体逸出):c(![]() )>c(CH3COOH)+c(H2CO3)
)>c(CH3COOH)+c(H2CO3)
D.0.4 mol·L1 CH3COOH溶液和0.2 mol·L1 NaOH溶液等体积混合(pH<7):c(CH3COOH)>c(CH3COO)>c(Na+)>c(H+)>c(OH)
【答案】AB
【解析】
A项、CH3COONa和CH3COOH混合溶液,包括CH3COO水解和CH3COOH电离两个过程,溶液pH=7,由电荷守恒关系可知c(Na+)=c(CH3COO)=0.1 mol·L1,c(H+)=c(OH)=1×107 mol·L1,溶液中存在醋酸,则c(CH3COOH)>c(H+),故A正确;
B项、20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7的溶液中存在电荷守恒关系:c(H+)+c(Na+)=c(OH)+c(CH3COO)+c(Cl),存在物料守恒关系:c(Na+)= c(CH3COOH)+c(CH3COO),由溶液中c(H+)=c(OH)可知c(CH3COOH)=c(Cl),故B正确;
C项、反应后溶液的成分是CH3COONa、NaHCO3,溶液显碱性,溶液中存在电荷守恒关系:c(H+)+c(Na+)=c(OH)+c(CH3COO)+c(HCO3)+2c(CO32),存在物料守恒关系:c(Na+)= c(CH3COOH)+c(CH3COO)+c(HCO3)+c(CO32)+c(H2CO3),两式相减可得:c(CO32)+c(OH)=c(CH3COOH)+c(H2CO3)+c(H+),溶液显碱性,溶液中c(OH)>c(H+),则c(CO32)<c(CH3COOH)+c(H2CO3),故C错误;
D项、0.4 mol·L1CH3COOH溶液和0.2 mol·L1NaOH溶液等体积混合,溶液中的成分是等物质的量的CH3COONa和CH3COOH,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COOH)<c(CH3COO),故D错误。
故选AB。