题目内容
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种常温下的液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________,C元素在周期表中的位置是_____。
(2)C和D的离子中,半径较小的是____(离子符号),以上元素中电负性最大的是____(元素符号)
(3)常温下将D的单质投入甲中,待D消失后再向上述溶液中加入E的固体单质,此时发生反应的化学方程式是______________。
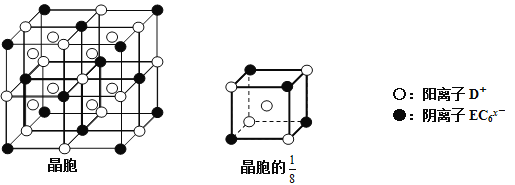
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
【答案】![]() 第二周期、第ⅦA族 Na+ F 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Na3AlF6
第二周期、第ⅦA族 Na+ F 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Na3AlF6
【解析】
A、B、C、D、E都是短周期主族元素,原子序数依次增大,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则A为H元素,B为O元素,甲为H2O、乙为H2O2;A、D同主族,则D为Na元素;B、C同周期,则C为F元素;结合(3)Al与碱反应,则E为Al元素。
(1)甲为H2O,含极性键的极性分子,乙为H2O2,含极性键、非极性键的极性分子,则H2O2的电子式为:![]() ;C为F元素,位于第二周期VIIA,故答案为:
;C为F元素,位于第二周期VIIA,故答案为:![]() ;第二周期VIIA;
;第二周期VIIA;
(2)C为F元素、D为Na元素,F-与Na+的核外电子层结构相同,原子序数大的离子半径小,故半径较小的是Na+;同周期,从左到右,电负性增大,同主族,从上到下,电负性减小,则电负性最大的是F,故答案为:Na+;F;
(3)D为Na元素,E为Al元素,甲为H2O,Na与水反应生成NaOH和H2,加入Al的固体单质,Al与NaOH反应生成偏铝酸钠和氢气,其化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)C、D、E分别为F、Na和Al,组成离子化合物NaxAlF6,该晶胞的![]() 中含有的Na+个数为1+4×
中含有的Na+个数为1+4×![]() =
=![]() ,阴离子AlF6x-个数为4×
,阴离子AlF6x-个数为4×![]() =
=![]() ,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6,故答案为:Na3AlF6。
,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6,故答案为:Na3AlF6。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案