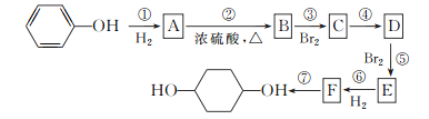
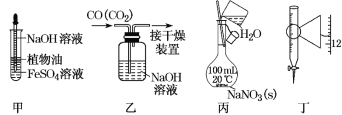
题目内容
【题目】铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306 ℃,沸点为315 ℃,易吸收空气中的水分而潮解。工业上采用向500~600 ℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670 ℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
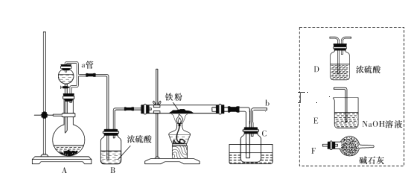
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,a管的作用是______________,反应的离子方程式为__________。
(2)导管b口应与_______________(从虚线框内装置中选择一个装置,用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(3)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.2 g样品溶于过量的稀盐酸中;②加入足量H2O2;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。则该样品中铁元素的质量分数为_________。
(4)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量___________ (填“偏高”或“偏低”),显然其中含有较多的___________(填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是 ______。
【答案】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 平衡压强,使液体顺利滴下 F 40% 偏高 FeCl2 在AB装置间增加一个饱和食盐水的洗气装置,除去氯气中混有的HCl
【解析】
由实验装置可知,A中发生2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,a管中导气管是维持分液漏斗和圆底烧瓶的压强相等,使液体顺利滴下。B中浓硫酸干燥氯气,C中发生2Fe+3Cl2-2FeCl3,水槽中冰水冷却,C中收集到FeCl3,若产物中混有FeCl2,可利用其还原性或与K3[Fe(CN)6]溶液生成蓝色沉淀检验,F为干燥管,F中为碱石灰可吸收未反应的氯气,且防止空气中水进入装置C中导致氯化铁水解,以此来解答。
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,a管中导气管是维持分液漏斗和圆底烧瓶的压强相等,使液体顺利滴下,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;平衡压强,使液体顺利滴下;
(2)仪器F的名称是干燥管;D中装的药品是碱石灰,其作用是吸收未反应的氯气,且防止空气中水进入装置C中导致氯化铁水解,
故答案为:F;
(3) )取装置C中的产物,按以下步骤进行测定:①称取4.20g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g,可知氧化铁为2.40g,由Fe元素守恒可知该样品中铁元素的质量分数为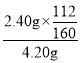 ×100%=40%,
×100%=40%,
故答案为:40%;
(4)①因盐酸易挥发,未除去氯气中的HCl,由FeCl2中Fe的质量分数大于FeCl3中Fe的质量分数可知,用题目所给的装置制得的产物中,铁元素含量偏高,说明含有FeCl2杂质,
故答案为:偏高;FeCl2;
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施在AB装置间增加一个饱和食盐水的洗气装置,除去氯气中混有的HCl,
故答案为:在AB装置间增加一个饱和食盐水的洗气装置,除去氯气中混有的HCl。