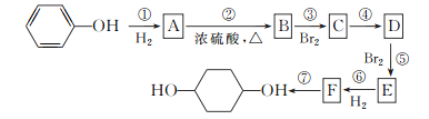
题目内容
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸HAsO2形式存在,还含有少量Fe3+等杂质)提取重要化工原料As2O3。工艺流程如下:
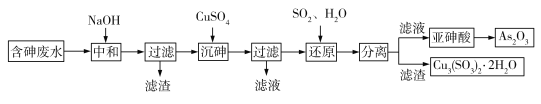
(1)“中和”时调节废水的pH为6,NaOH的作用是_____。
(2)“沉砷”时生成的沉淀是Cu(AsO2)2,发生反应的离子方程式是_____;此时使用了过量的CuSO4,原因是_____;沉砷时需控制体系的pH略显碱性,测得Cu(AsO2)2产物中铜元素含量较高,原因是_____。
(3)“还原”时发生反应的化学方程式是_____。
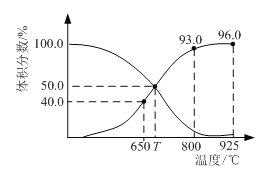
(4)下图表示其他条件不变下“还原”时,反应温度对砷浸出率和铜浸出率的影响(浸出率表示溶液中所要提取的元素被浸出的程度,即元素被浸出的百分率):
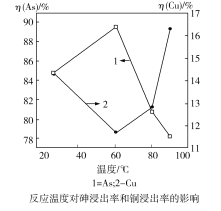
为达到铜砷分离尽量彻底的目的,应选择的最佳温度是_____。
【答案】中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为![]() Cu2++2
Cu2++2![]()
![]() Cu(AsO2)2↓ 为了充分回收砷 产物含有少量氢氧化铜沉淀 3Cu(AsO2)2+3SO2+6H2O
Cu(AsO2)2↓ 为了充分回收砷 产物含有少量氢氧化铜沉淀 3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4 60 ℃
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4 60 ℃
【解析】
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸HAsO2形式存在,还含有少量Fe3+等杂质)提取重要化工原料As2O3。根据工艺流程图可知:加入NaOH,一方面中和酸性高浓度含砷废水中的氢离子,另一方面使杂质离子Fe3+形成沉淀除去,还可以将HAsO2转化为AsO2-,便于沉砷,加入CuSO4后转化为Cu(AsO2)2,过滤后加入SO2后转化为HAsO2加热可得As2O3。结合流程分析完成相应的问题。
(1)加入NaOH,一方面中和酸性高浓度含砷废水中的氢离子,另一方面使杂质离子Fe3+形成沉淀除去,还可以将HAsO2转化为![]() ,便于沉砷。答案:中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为AsO2-。
,便于沉砷。答案:中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为AsO2-。
(2)沉砷中![]() 与Cu2+形成沉淀:Cu2++2
与Cu2+形成沉淀:Cu2++2![]()
![]() Cu(AsO2)2↓;使用了过量的CuSO4,是为了充分回收砷;体系的pH略显碱性,容易形成氢氧化铜沉淀,氢氧化铜与Cu(AsO2)2相比,氢氧化铜中含铜量较高。答案:Cu2++2
Cu(AsO2)2↓;使用了过量的CuSO4,是为了充分回收砷;体系的pH略显碱性,容易形成氢氧化铜沉淀,氢氧化铜与Cu(AsO2)2相比,氢氧化铜中含铜量较高。答案:Cu2++2![]()
![]() Cu(AsO2)2↓ ;为了充分回收砷;产物含有少量氢氧化铜沉淀。
Cu(AsO2)2↓ ;为了充分回收砷;产物含有少量氢氧化铜沉淀。
(3)反应物是Cu(AsO2)2、SO2、H2O,生成物是 Cu3(SO3)2·2H2O和 HAsO2,Cu元素化合价降低,可知部分S元素化合价升高,根据原子守恒还有H2SO4生成,配平得:3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。答案:3Cu(AsO2)2+3SO2+6H2O
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。答案:3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。
(4)根据图示,在60 ℃时,砷的浸出率最高,铜的浸出率最低,可以达到铜砷分离尽量彻底的目的。答案:60 ℃。