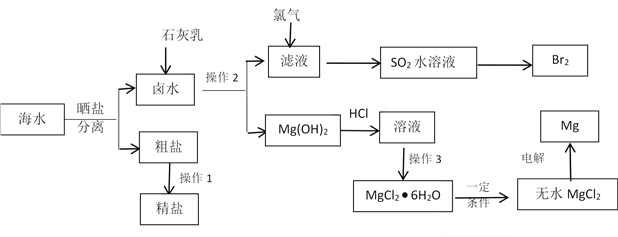
题目内容
【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。
【答案】 0.125 mol·L-1·min-1 < 升温 加压 0.4<z≤1 酸 c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-) c(HSO3-) + 2c(SO32-) -c(NH4+) 或 c(SO32-) + c(NH3·H2O) - c(H2SO3) 负 SO2-2e-+2H2O![]() 4H++SO42-
4H++SO42-
【解析】(1)①该反应在0~8 min内氢气减少了8mol-2mol=6mol,则根据方程式可知消耗CO2是2mol,浓度是1.0mol/L,所以CO2的平均反应速率为1.0mol/L÷8min=0.125 mol·L-1·min-1。②根据图像可知平衡时氢气是2mol,CO2是6mol-2mol=4mol,生成甲醇和水蒸气均是2mol,浓度分别是(mol/L)2、1、1、1,因此该温度下平衡常数K=![]() 。第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则浓度熵Q=
。第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则浓度熵Q=![]() >0.5,反应向逆反应方向进行,则v正<v逆。③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ到达平衡的时间减少,且平衡时氢气的物质的量增加,平衡向逆反应方向进行,由于正反应是放热的体积减少的可逆反应,因此改变的条件可能是升高温度。曲线Ⅱ到达平衡的时间减少,且平衡时氢气的物质的量减少,平衡向正反应方向进行,因此改变的条件可能是增大压强。④根据题意可知甲、乙达到的平衡是等效平衡,先计算甲中平衡时各物质的物质的量,设甲中二氧化碳的物质的量减少xmol,则
>0.5,反应向逆反应方向进行,则v正<v逆。③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ到达平衡的时间减少,且平衡时氢气的物质的量增加,平衡向逆反应方向进行,由于正反应是放热的体积减少的可逆反应,因此改变的条件可能是升高温度。曲线Ⅱ到达平衡的时间减少,且平衡时氢气的物质的量减少,平衡向正反应方向进行,因此改变的条件可能是增大压强。④根据题意可知甲、乙达到的平衡是等效平衡,先计算甲中平衡时各物质的物质的量,设甲中二氧化碳的物质的量减少xmol,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol) 1 3 0 0
转化(mol) x 3x x x
平衡(mol) 1-x 3-3x x x
根据题意,1-x+3-x+x+x=0.8×(1+3)mol,解得x=0.4mol,因为乙是从逆反应开始的,所以z>0.4mol,又因为二者是等效平衡,将甲的反应物完全转化为生成物时,甲醇的物质的量是1mol,水蒸气的物质的量是1mol,所以z ≤1mol,因此z的取值范围是0.4<z ≤1。(2)①将等物质的量的SO2与NH3溶于水充分反应生成亚硫酸氢铵,亚硫酸的第一步电离常数大于一水合氨,说明铵根的水解程度大于亚硫酸氢根离子,因此所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-)。所得溶液中根据电荷守恒可知c(H+)-c(OH-)= c(HSO3-) + 2c(SO32-) -c(NH4+)或者依据质子守恒可知c(H+)-c(OH-)= c(SO32-) + c(NH3·H2O) - c(H2SO3);② SO2失去电子转化为硫酸,则若A为SO2,B为O2,则A为负极,该极电极反应式为SO2-2e-+2H2O=4H++SO42-。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】工业上用O2将HCl转化为Cl2,可减少污染。
(1)在传统催化剂并加热条件下可实现该转化:4HCl+O2![]() 2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
已知:新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
(2)新型RuO2催化剂的使用对于平衡常数的影响是:__________(选填“变大了”、“变小了”或“无影响”)。 实验测得在一定压强下,该反应的HCl平衡转化率随温度变化的αHCl—T曲线如下图,该反应是__________(选填“放热反应”、“吸热反应”或“没有明显的放热或吸热”);A、B两点的平衡常数K(A)与K(B)中较大的是____________________。

(3)若其它条件不变,压缩体积使压强增大,则αHCl将__________(选填“增大”、“减小”或“不变”),并简要说明理由:___________________。
(4)一定条件下,2升密闭容器中,测得反应过程中n(Cl2)的数据如下:
(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的变化表示的反应速率_________________。
(5)Cl2用途广泛,写出用Cl2制备漂粉精的化学方程式:______________。
其中漂粉精的有效成分是:_________________(填物质名称),它在空气中易变质的主要原因是:_______________________。