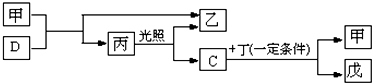
题目内容
直接排放含SO2 的气体会形成酸雨,危害环境.
(1)在大气中SO2形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ;
(2)钠碱循环法用Na2SO3溶液作为吸收液,可脱除烟气中SO2,吸收液吸收SO2 的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
判断NaHSO3溶液显 性,用化学平衡原理解释 ;
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则HSO3-在阳极放电的电极反应式是 ;
(4)若用烧碱溶液吸收SO2,①向100mL 1molL-1 aOH溶液中不断通入一定量SO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按SO2通入量由少到多出现的先后顺序分别是:I.NaOH、Na2SO3,Ⅱ. ,Ⅲ.Na2SO3、NaHSO3,Ⅳ. ;
②若要验证白色固体X是第I种组成,依次加入的试剂为 (填序号字母).
a.盐酸 b. MgCl2溶液 c.BaCl2溶液 d. Ba(OH)2溶液 e.酚酞试液
(5)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式 .
(1)在大气中SO2形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式
(2)钠碱循环法用Na2SO3溶液作为吸收液,可脱除烟气中SO2,吸收液吸收SO2 的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则HSO3-在阳极放电的电极反应式是
(4)若用烧碱溶液吸收SO2,①向100mL 1molL-1 aOH溶液中不断通入一定量SO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按SO2通入量由少到多出现的先后顺序分别是:I.NaOH、Na2SO3,Ⅱ.
②若要验证白色固体X是第I种组成,依次加入的试剂为
a.盐酸 b. MgCl2溶液 c.BaCl2溶液 d. Ba(OH)2溶液 e.酚酞试液
(5)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式
考点:二氧化硫的污染及治理,电解原理,二氧化硫的化学性质
专题:元素及其化合物
分析:(1)二氧化硫与水反应生成亚硫酸,亚硫酸与空气中氧气反应生成硫酸,据此写出反应的化学方程式;
(2)当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,据此判断NaHSO3溶液的酸碱性及解释原因;
(3)当吸收液的pH降至约为6时,溶液中阴离子主要为HSO3-,具有还原性,在阳极上放电发生氧化反应;
(4)①由于SO2和NaOH反应时物质的量之比不同则产物不同,故可根据SO2和NaOH反应时物质的量之比对产物进行讨论;
②验证白色固体X是第I种组成NaOH、Na2SO3,需要验证亚硫酸根离子和氢氧根离子,分析选项试剂可知利用氯化钡溶液检验亚硫酸根离子,依据氢氧化钠或酚酞试液检验氢氧根离子的存在;验证过程中需要把沉淀过滤后再检验氢氧根离子;
(5)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子,据此写出反应的离子方程式.
(2)当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,据此判断NaHSO3溶液的酸碱性及解释原因;
(3)当吸收液的pH降至约为6时,溶液中阴离子主要为HSO3-,具有还原性,在阳极上放电发生氧化反应;
(4)①由于SO2和NaOH反应时物质的量之比不同则产物不同,故可根据SO2和NaOH反应时物质的量之比对产物进行讨论;
②验证白色固体X是第I种组成NaOH、Na2SO3,需要验证亚硫酸根离子和氢氧根离子,分析选项试剂可知利用氯化钡溶液检验亚硫酸根离子,依据氢氧化钠或酚酞试液检验氢氧根离子的存在;验证过程中需要把沉淀过滤后再检验氢氧根离子;
(5)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子,据此写出反应的离子方程式.
解答:
解:(1)在大气中SO2形成硫酸型酸雨有二种途径,其中一种途径为:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4,
故答案为:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)由于HSO3-在溶液中存在如下两平衡:HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,由表中数据可知,当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,证明HSO3-的电离程度大于水解程度,
故答案为:酸性;HSO3-在溶液中存在如下两平衡:HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,由表中数据可知,当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,证明HSO3-的电离程度大于水解程度;
(3)当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3--2e-+H2O=SO42-+3H+;
(4)①由反应方程式SO2+2NaOH=Na2SO3+H2O①、CO2+NaOH=NaHSO3②可知
n(SO2):n(NaOH)=
时产物为Na2SO3,
n(SO2):n(NaOH)=1时产物为NaHSO3,
所以n(SO2):n(NaOH)<
时,NaOH 过量则产物为Na2SO3+NaOH;
<n(SO2):n(NaOH)<1时,对于①反应来说二氧化硫过量而对于②反应来说二氧化硫的量不足,所以产物为Na2SO3+NaHSO3;
n(SO2):n(NaOH)>1时,二氧化硫过量,则固体产物为NaHSO3,
向100mL 1mol?L-1烧碱溶液中不断通入一定量SO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、Na2SO3;Na2SO3;Na2SO3、NaHSO3;NaHSO3;
故答案为:Na2SO3; NaHSO3;
②验证白色固体X是第I种组成NaOH、Na2SO3,需要验证亚硫酸根离子和氢氧根离子,可以先加入c.BaCl2溶液检验亚硫酸根离子,后加入b. MgCl2溶液检验氢氧化钠,或先加入过量c.BaCl2溶液检验亚硫酸钠,然后加入e.酚酞试液检验强氧化,
故答案为:cb(或ce);
(5)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
故答案为:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)由于HSO3-在溶液中存在如下两平衡:HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,由表中数据可知,当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,证明HSO3-的电离程度大于水解程度,
故答案为:酸性;HSO3-在溶液中存在如下两平衡:HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,由表中数据可知,当n(SO32-):n(HSO3-)=9:91时,溶液中主要存在HSO3-,此时pH=6.2溶液显酸性,证明HSO3-的电离程度大于水解程度;
(3)当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3--2e-+H2O=SO42-+3H+;
(4)①由反应方程式SO2+2NaOH=Na2SO3+H2O①、CO2+NaOH=NaHSO3②可知
n(SO2):n(NaOH)=
| 1 |
| 2 |
n(SO2):n(NaOH)=1时产物为NaHSO3,
所以n(SO2):n(NaOH)<
| 1 |
| 2 |
| 1 |
| 2 |
n(SO2):n(NaOH)>1时,二氧化硫过量,则固体产物为NaHSO3,
向100mL 1mol?L-1烧碱溶液中不断通入一定量SO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、Na2SO3;Na2SO3;Na2SO3、NaHSO3;NaHSO3;
故答案为:Na2SO3; NaHSO3;
②验证白色固体X是第I种组成NaOH、Na2SO3,需要验证亚硫酸根离子和氢氧根离子,可以先加入c.BaCl2溶液检验亚硫酸根离子,后加入b. MgCl2溶液检验氢氧化钠,或先加入过量c.BaCl2溶液检验亚硫酸钠,然后加入e.酚酞试液检验强氧化,
故答案为:cb(或ce);
(5)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评:本题考查了二氧化硫的化学性质、盐的水解原理及其影响、原电池工作原理等知识,题目难度中等,试题题量较大,涉及的知识点较多,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
下列物质中互为同分异构体的是( )
| A、CH3CH2CH2CH3 |
B、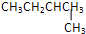 |
C、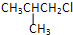 |
| D、CH3CH2CH2CH2Cl |
下列化学用语正确的是( )
A、H2S的电子式: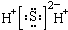 |
B、钙原子结构示意图: |
C、Na2O2的电子式: |
| D、铁离子:Fe2+ |
绿色化学对于化学反应提出了“原子经济性”的要求.理想的原子经济性反应是原料中的原子全部转化为产物,不产生副产品,实现零排放.下列几种生产乙苯的方法中,原子经济性最好的是( )
A、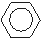 +C2H5Cl→ +C2H5Cl→ +HCl +HCl |
B、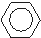 +C2H5OH→ +C2H5OH→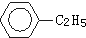 +H2O +H2O |
C、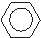 +CH2═CH2→ +CH2═CH2→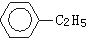 |
D、 +CH3CH3→ +CH3CH3→ +HCl +HCl |
某物质灼烧时焰色反应为黄色,下列判断正确的是( )
| A、该物质一定是钠的化合物 |
| B、该物质一定含钠元素 |
| C、该物质一定是金属钠 |
| D、以上说法都不对 |
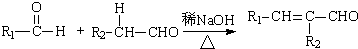 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基) 、
、 、
、