题目内容
4. 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:(1)该硫酸的物质的量浓度是18.4 mol/L.
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol/L的稀H2SO4,则需要取6.5mL的该硫酸,将上述硫酸进行稀释的实验操作为将浓硫酸沿烧杯内壁注入水中,边注边用玻璃杯搅拌.
(3)在配制4.6mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”).
①未经冷却趁热溶液注入容量瓶中:偏高.
②容量瓶用1mol/L稀H2SO4润洗:偏高.
③定容时仰视观察液面偏低.
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加入几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析其原因常温下,铝在浓硫酸中钝化.
分析 (1)根据物质的量浓度C=$\frac{1000ρω%}{M}$来计算;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,所配置出的是250mL 4.6mol/L的稀H2SO4,根据溶液稀释定律C浓V浓=C稀V稀来计算所需的浓硫酸的体积;根据浓硫酸稀释放热来分析其稀释的操作;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)常温下,铝在浓硫酸里会钝化.
解答 解:(1)此硫酸的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,故答案为:18.4;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,所配置出的是250mL 4.6mol/L的稀H2SO4,设所需的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=250mL×4.6mol/L,解得V=6.5mL;由于浓硫酸稀释放热,故稀释时应将浓硫酸沿烧杯内壁注入水中,边注边用玻璃杯搅拌,故答案为:6.5;将浓硫酸沿烧杯内壁注入水中,边注边用玻璃杯搅拌;
(3)①未经冷却趁热溶液注入容量瓶中,则溶液冷却后体积会偏小,浓度偏高,故答案为:偏高;
②容量瓶用1mol/L稀H2SO4润洗,会导致容量瓶中的硫酸的物质的量增多,则配制后溶液的浓度偏高,故答案为:偏高;
③定容时仰视观察液面,会导致溶液体积偏大,则浓度偏低,故答案为:偏低;
(4)常温下,铝在浓硫酸里会钝化,钝化虽然也是化学反应,但程度很小,故铝片表面没有气泡产生,也未发现铝片溶解,故答案为:常温下,铝在浓硫酸中钝化.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 期末集结号系列答案
期末集结号系列答案| A. | 塑料、合成纤维、合成橡胶都是小分子经加聚反应合成 | |
| B. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| C. | 石油催化重整的目的是为了获得芳香烃 | |
| D. | 重油减压分馏可以降低烃的沸点,使之在较低的温度被蒸出 |
| A. | 苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸在浓硫酸作用下制硝基苯 | |
| C. | 乙醇与乙酸的酯化反应 | |
| D. | 一定条件下苯与氢气反应制环己烷 |
①苯不能使KMnO4溶液褪色;
②苯能在一定条件下跟H2加成生成环己烷;
③
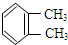 与
与 是同一物质;
是同一物质;④苯不能因化学变化而使溴水褪色.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
| A. | CO2和SiO2 | B. | Na和I2 | C. | 蔗糖和干冰 | D. | 金刚石和石墨 |
 .
.