题目内容
10.取Na2C03、Na2S04的混合溶液,加入过量的BaCl2溶液后,得到14.51g白色沉淀,用过量的稀硝酸处理后,沉淀量减少到4.66g,用去稀硝酸50ml.试计算:(1)原混合物中Na2C03、Na2S04的物质的量;
(2)稀硝酸的物质的量浓度.
分析 碳酸钠、硫酸钠都能够与氯化钡反应,分别生成碳酸钡沉淀、硫酸钡沉淀,碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据沉淀质量的变化计算碳酸钠和硫酸钠的物质的量,根据反应的方程式计算消耗的硝酸的物质的量和浓度.
解答 解:(1)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据原子个数守恒得:
n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,
14.51g白色沉淀为BaSO4和BaCO3的混合物,其中不溶于稀硝酸的是4.66g BaSO4,
则BaCO3质量为:14.51g-4.66g=9.85g.
n(Na2CO3)=n(BaCO3)=$\frac{9.85g}{197g/mol}$=0.05mol;
答:原混合溶液中Na2SO4的物质的量为0.02mol,Na2C03的物质的量为0.05mol;
(2)设消耗的硝酸为xmol.
BaCO3+2HNO3 ══Ba(NO3)2+CO2↑+H2O
1mol 2mol
0.05mol x
则x=0.1mol,则硝酸的浓度为c=$\frac{0.1mol}{0.05L}$=2mol/L;
答:稀硝酸的物质的量浓度为2mol/L.
点评 本题考查了有关方程式的计算,明确反应的实质是解题关键,注意碳酸钡和硫酸钡的性质,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
20.一定量的0.2mol/L NaCl溶液和0.1mol/L MgCl2溶液混合后,Cl-物质的量浓度为( )
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 任意比 |
18.已知甲烷、氢气、一氧化碳的燃烧热依次为-a kJ•mol-1、-b kJ•mol-1、-c kJ•mol-1、(a、b、c均大于0).工业上,利用天然气与水蒸汽或二氧化碳在高温下反应制备C0和H2:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H1
CH4(g)+H2O(l)=CO(g)+3H2(g)△H2
试推算$\frac{△{H}_{1}}{△{H}_{2}}$等于( )
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H1
CH4(g)+H2O(l)=CO(g)+3H2(g)△H2
试推算$\frac{△{H}_{1}}{△{H}_{2}}$等于( )
| A. | $\frac{2b-2c-a}{3b+c+a}$ | B. | $\frac{2b+2c-a}{3b-c-a}$ | C. | $\frac{2b+c-2a}{3b+2c-a}$ | D. | $\frac{2b+2c-a}{3b+c-a}$ |
8.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| C. | 葡萄糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
5.下列反应的离子方程式错误的是( )
| A. | 等物质的量的Ba (OH)2与NH4HSO4在溶液中反应:Ba2++2OH-+NH4++H++SO42-→BaSO4↓+NH3•H2O+H2O | |
| B. | 氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+→Fe3++3H2O | |
| C. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2→2Fe3++2Cl- | |
| D. | 酸性条件下KIO3溶液和KI溶液反应生成I2:IO3-+5I-+3H2O→3I2+6OH- |
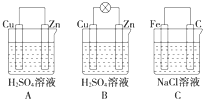 观察图A、B、C,回答下列问题:
观察图A、B、C,回答下列问题: