题目内容
6.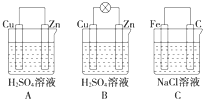 观察图A、B、C,回答下列问题:
观察图A、B、C,回答下列问题:(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,可以看到铁生锈,写出负极的电极反应式:Fe-2e-=Fe2+.
(3)如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,锌反应掉32.5克,转移电子1mol.
分析 (1)金属铜和硫酸不反应,锌片、铜片和硫酸形成的原电池中,金属铜为正极;
(2)铁片、石墨和氯化钠溶液构成的原电池中,金属铁发生吸氧腐蚀;
(3)根据电极反应方程式来计算.
解答 解:(1)金属铜和硫酸不反应,不会产生气泡,锌片、铜片和硫酸形成的原电池中,金属铜为正极,该极上氢离子得电子生成氢气,电极反应为:2H++2e-=H2↑,故答案为:没有;2H++2e-=H2↑;
(2)铁片、石墨和氯化钠溶液构成的原电池中,金属铁发生吸氧腐蚀,负极上是铁失电子发生氧化反应,电极反应为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)根据正极反应:2H++2e-=H2↑,当在标准状况下收集到11.2L即0.5mol的氢气时,转移电子是1mol,负极上的电极反应式为:Zn-2e-=Zn2+,当转移电子1mol时,锌反应掉0.5×65=32.5g;
故答案为:32.5g;1.
点评 本题考查学生原电池的工作原理知识,可以根据所学知识来回答,较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列实验操作或记录正确的是( )
| A. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 常温常压下测得1 mol N2的质量为28 g | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
1.关于取代反应和置换反应的下列说法中,正确的是( )
| A. | 取代反应和置换反应中一定都有单质生成 | |
| B. | 取代反应的反应物一定都是有机物,置换反应的反应物一定都是无机物 | |
| C. | 取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快 | |
| D. | 取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象 |
11.下列除去杂质的操作方法正确的是( )
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | N2中有少量的O2:通过足量灼热的氧化铜 | |
| D. | 硝酸中溶有少量NO2,可向硝酸中加入少量水,使NO2与水反应生成硝酸 |
18.下列实验设计所得结论可靠的是( )
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH的乙醇溶液共热产生的气体通入到酸性KMnO4溶液中,溶液褪色说明有CH2=CH2生成 | |
| C. | 将溴乙烷与NaOH的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,说明有HBr生成 |
15.有关SO2说法错误的是( )
| A. | 单质硫在空气中燃烧可生成SO2 | |
| B. | SO2能使品红溶液褪色,加热可恢复红色 | |
| C. | SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应 | |
| D. | SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物,可大大增强漂白作用 |
16.下列物质中,在一定条件下不能与乙烯发生加成反应的是( )
| A. | 氢气 | B. | 水 | ||
| C. | 氧气 | D. | 溴的四氯化碳溶液 |