题目内容
12.二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3为原料合成尿素.经研究发现该反应过程为:
①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
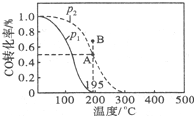
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.
分析 (1)根据温度对平衡移动的影响判断反应热的符号;
(2)①根据v=$\frac{△c}{△t}$进行计算;
②升高温度,化学反应速率加快,依此根据10min内,T2时CO2转化率大于T1时判断温度的高低;
T2℃下,10min时CO2转化率为45%,20min时CO2转化率为50%,10-20min只转化5%,说明20min时已达平衡状态,依此判断第30min时CO2转化率;
根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
③根据浓度商和平衡常数的大小关系,判断反应进行的方向;
(3)当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应;根据反应①②的能力变化情况作图.
解答 解:(1)根据图象可知达到平衡后,温度越高,平衡常数越小,说明升高温度平衡逆向移动,则正反应方向为放热反应,则△H<0,
故答案为:<;
(2)①C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g),
T1℃下,lOmin内CO2转化率为30%,故参加反应的二氧化碳的物质的量为:2mol×30%=0.6mol,则参加反应的氨气的物质的量为:0.6mol×2=1.2mol,
故lOmin内NH3的平均反应速率为$\frac{\frac{1.2mol}{3L}}{10min}$=0.04mol•L-1•min-1,
故答案为:0.04mol•L-1•min-1;
②升高温度,化学反应速率加快,10min内,T2时CO2转化率大于T1时,故T2>T1;
T2℃下,10min时CO2转化率为45%,20min时CO2转化率为50%,10-20min只转化5%,说明20min时已达平衡状态,故第30min时,CO2转化率为50%;
平衡时,CO2转化率为50%,故参加反应的二氧化碳的物质的量为:2mol×50%=1mol,则参加反应的氨气的物质的量为:1mol×2=2mol,生成水蒸气的物质的量为1mol,则平衡时,二氧化碳的物质的量为2-1=1mol,氨气的物质的量为3-2=1mol,水蒸气的物质的量为1mol,故平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2})•{c}^{2}(N{H}_{3})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×\frac{1}{3}×\frac{1}{3}}$=9,
故答案为:<,50%,9;
③T2℃下,原反应达平衡时,二氧化碳的物质的量为1mol,氨气的物质的量为1mol,水蒸气的物质的量为1mol,则气体总的物质的量为3mol,T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,则容器体积变为原来的2倍,即3L×2=6L,Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×\frac{1}{6}×\frac{1}{6}}$=9=K,故平衡不移动,v(正)=v(逆),
故答案为:=,T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动;
(3)当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,据反应①C02(g)+2NH3(g)?NH2COONH4(s)△H1<0,反应②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量,故合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图为: ,
,
故答案为: .
.
点评 本题考查化学反应速率影响因素及相关计算、化学平衡的移动原理、平衡常数的相关计算等知识,难度较大.

 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
| A. | 按系统命名法,化合 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: |
| A. | 1mol甲苯含C-H键的数目为6NA | |
| B. | 反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中生成28gN2时,转移电子数目为15NA | |
| C. | 1molFeCl3与水反应完全转化为氢氧化铁胶体后,胶体粒子的数目为NA | |
| D. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| A. | Li的原子结构示意图为 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
| A. | 电子式 可以表示烃基,也可以表示氢氧根离子 可以表示烃基,也可以表示氢氧根离子 | |
| B. | 磷原子的简化电子排布式:[He]3s23p3 | |
| C. | 聚丙烯链节的结构简式为:-CH2-CH-CH2- | |
| D. | 用惰性电极电解MgCl2溶液的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓ |
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |