��Ŀ����
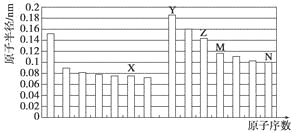
����Ŀ��ȷ��ȡ6g��������Ʒ����Al2O3��Fe2O3��SiO2��������100mLŨ�ȵ�H2SO4��Һ�У���ַ�Ӧ����ˣ�����Һ�м���10mol/L��NaOH��Һ���������������NaOH��Һ������Ĺ�ϵ����ͼ��ʾ����
��1��ԭ��Һ��c��H2SO4��= mol/L
��2����a=2.3mL���������ֵ�������
m��Al2O3��= g��m��Fe2O3��= g��
��3������aֵ��ȡֵ��Χ�� ����a�� ��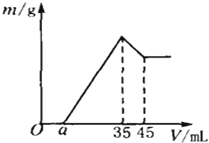
���𰸡�1.75��5.1��0.72��1.625��5
����������1��������NaOH��Һ�����Ϊ35mlʱ��n��NaOH��=0.035L��10mol/L=0.35mol��
��ʱ�����������ﵽ���ֵ�����ʱ��Һ������ֻ��Na2SO4 ��
����NaԪ���غ���n��Na2SO4��=![]() n��NaOH��=
n��NaOH��=![]() ��0.35mol=0.175mol��
��0.35mol=0.175mol��
����������غ㣬���У�n��H2SO4��=0.175mol��
����ԭ������Һ��c��H2SO4��=![]() =1.75mol/L��
=1.75mol/L��
���Դ��ǣ�1.75��
��2����35mL��45mL�����10mL����������ȫ�ܽ������������ý����ĵ�n��NaOH��=0.01L��10mol/L=0.1mol�����ݷ���ʽAl��OH��3+NaOH=NaAlO2+2H2O��֪��n[Al��OH��3]=0.1mol������Һ��n��Al3+��=0.1mol������AlԪ���غ��֪n��Al2O3��=![]() ��0.1mol=0.05mol����m��Al2O3��=0.05mol��102g/mol=5.1g��
��0.1mol=0.05mol����m��Al2O3��=0.05mol��102g/mol=5.1g��
��������ȫ���������������Ƶ����ʵ���Ϊ0.1mol��3=0.3mol�������ӡ���������ȫ�������ĵ�����������Һ�����Ϊ35mL��2.3mL=32.7mL���ʸý�����n��NaOH��=0.0327L��10mol/L=0.327mol������������ȫ�������ĵ��������Ƶ����ʵ���Ϊ0.327mol��0.3mol=0.027mol����n��Fe3+��=![]() =0.009mol����m��Fe2O3��=0.009mol��
=0.009mol����m��Fe2O3��=0.009mol��![]() ��160g/mol=0.72g��
��160g/mol=0.72g��
���Դ��ǣ�5.1��0.72��
��3�����������ʵ���Ϊ0.1mol�����ݼ�ֵ������a�ķ�Χ��ֻ��������ʱ������Ҫ�����������ʵ���Ϊ0.3mol����Ҫ����������Һ���Ϊ30ml����a=35ml��30ml=5ml������Ʒ�к�����������aһ��С��5ml������6gij��ʯ��Ʒ��ֻ�к�Al2O3��Fe2O3 �� ���ݣ�2�������֪m��Al2O3��=5.1g����m��Fe2O3��=6g��5.1g=0.9g��n��Fe2O3��=![]() =0.005625mol��n��Fe3+��=0.005625mol��2=0.01125mol����������������0.03375mol����Ӧ�γ�������������������������ʵ���Ϊ0.03375mol+0.3mol=0.33375mol����Ҫ����������Һ�����Ϊ
=0.005625mol��n��Fe3+��=0.005625mol��2=0.01125mol����������������0.03375mol����Ӧ�γ�������������������������ʵ���Ϊ0.03375mol+0.3mol=0.33375mol����Ҫ����������Һ�����Ϊ![]() =0.033375L=33.375L������a��СΪ35ml��33.375ml=1.625ml����a��ȡֵΪ��1.625��a��5��
=0.033375L=33.375L������a��СΪ35ml��33.375ml=1.625ml����a��ȡֵΪ��1.625��a��5��

 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д�����Ŀ���±��г��ˢ�����ʮ��Ԫ�������ڱ��е�λ�ã�
��A | ||||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | �� |
�밴Ҫ��ش��������⡣
��1��Ԫ�آ��Ӧ�ļ����ӵĽṹʾ��ͼ��____________��
��2������Ԫ���У���ѧ��������õ��� ____________����Ԫ�ط��ţ���
��3��д��Ԫ�آ��γɵĵ����ڿ�����ȼ�յĻ�ѧ����ʽ______________________����һ��Ӧ��____________(��������������������)��Ӧ��
��4���õ���ʽ��ʾ������γɵ�A2B�ͻ�������γɹ���___________________________��
��5������ЩԪ�ص�����������Ӧˮ�����У�������ǿ�Ļ�����ķ���ʽ�ǣ�__________����Ԫ�آ�����������Ӧˮ����������Ӧʱ�����ӷ���ʽΪ________________
��6���۵ļ��⻯����۵�����������Ӧ��ˮ���ﷴӦ���������к��еĵĻ�ѧ����____________________________��