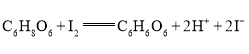题目内容
【题目】一定条件下,在体积固定的密闭容器中通入2.0 mol SO2、1.2molO2,发生反应2SO2(g) + O2(g)![]() 2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
A.2SO2(g) + O2(g) ![]() 2SO3(s) ΔH< -198kJ·mol-1
2SO3(s) ΔH< -198kJ·mol-1
B.增加反应物的量不能改变上述反应的ΔH
C.充分反应后,放出的热量小于198 kJ
D.若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60%
【答案】D
【解析】
A项、SO3由气态到固态释放能量,由盖斯定律可知,生成SO3固体时ΔH< -198kJ·mol-1,故A正确;
B项、增加反应物的量,平衡向正反应方向移动,消耗量增大,放出的热量增大,但ΔH不变,故B正确;
C项、该反应为可逆反应,2.0 mol SO2和1.2molO2不可能完全反应,则放出的热量小于198 kJ,故C正确;
D项、若从反应开始到建立平衡放出热量158.4 kJ,由方程式可知消耗SO2的物质的量为![]() ,则SO2的转化率为
,则SO2的转化率为![]() ×100%=80%,故D错误;
×100%=80%,故D错误;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目