题目内容
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐为沉淀。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。甲组、乙组两位同学对草酸分解产物进行探究。甲组同学认为:草酸分解产物中有CO2;乙组同学认为:草酸分解产物中还有CO。回答下列问题:
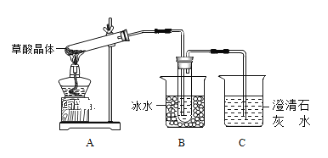
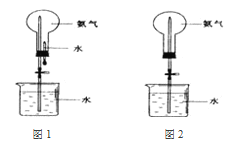
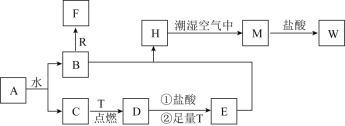
(1)甲组同学按照上图所示的装置连接,通过实验检验草酸晶体的分解产物。加热A装置前需要进行的操作是______________________;装置C中可观察到的现象是______________________________,装置C中发生的化学方程式_________________;由此可知草酸晶体分的产物中有___________(填化学式)。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验.
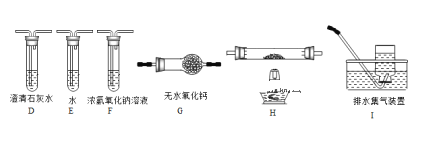
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G____________(按合理顺序补全装置,填大写字母)。装置H反应管中盛有的物质是______________,此反应管中发生反应的化学方程式是_______________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________________________________
【答案】检查装置的气密性 有气泡冒出且澄清石灰水变浑浊 CO2 +Ca(OH)2=CaCO3↓ +H2O CO2 H、D、I CuO(氧化铜) CO +CuO![]() Cu+CO2 H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
Cu+CO2 H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
【解析】
(1) 草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,B装置温度较低,有冷凝作用,防止干扰实验;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO的还原性将CO氧化,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊。
(1)有气体生成的密闭装置,在添加药品前需要检验装置气密性;草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有CO2气体生成,此时发生反应的化学方程式为CO2 +Ca(OH)2=CaCO3↓ +H2O;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,所以其连接顺序是A、B、F、D、G、H、D、I; H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO,发生反应的化学方程式为CO +CuO![]() Cu+CO2;
Cu+CO2;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,只要H中黑色固体转化为红色且其后的D装置溶液变浑浊就说明含有CO。

【题目】实验小组制备NaNO2,并探究其性质。
I.制备NaNO2
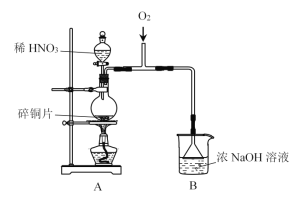
(1)A中发生反应的化学方程式是__________。
(2)B中选用漏斗替代长直导管的优点是________。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2 mLB中溶液 | 加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2 mLB中溶液 | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2 mLH2O | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是________。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是_________。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)溶液迅速变为棕色的原因是_________。
(6)已知棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是_________。
(7)最终棕褐色溶液的成分是Fe(OH)x(SO4)y,测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
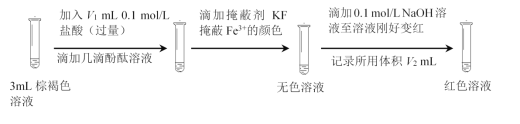
Fe(OH)x(SO4)y中x=_______(用含V1、V2的代数式表示)。
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。