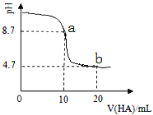
题目内容
【题目】铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:

则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A. I2、H2O2、KMnO4、NaBiO3B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2D. KMnO4、NaBiO3、I2、H2O2
【答案】C
【解析】
根据发生的反应中,氧化剂的氧化性大于氧化产物的氧化性这一规律来回答判断。
铋酸钠(NaBiO3)溶液呈无色,硫酸锰(MnSO4)溶液,溶液显紫色,则NaBiO3(氧化剂)的氧化性强于KMnO4(氧化产物)的氧化性;
由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则KMnO4(氧化剂)的氧化性强于H2O2(氧化产物)的氧化性;
由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性,
综上所述,NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序是:NaBiO3>KMnO4>H2O2>I2,故C正确;
答案选C。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目