题目内容
【题目】铁、钴、镍及其化合物有许多用途。回答下列问题:
(1)基态铁原子核外共有____________种不同空间运动状态的电子,铁、钴、镍基态原子核外未成对电子数最少的价层电子的电子排布图(轨道表达式)为_________________。
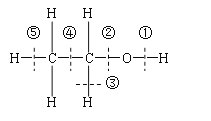
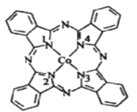
(2)酞菁钴分子的结构简式如图所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1”“2”“3”或“4”),分子中三种非金属原子的电负性由大到小的顺序为____________(用相应的元素符号表示),分子中碳原子的杂化轨道类型为____________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,该晶体固态下不导电,熔融状态、水溶液均能导电,该晶体属于____(填晶体类型)。配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为16,则x=___。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是______。
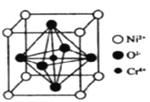
(5)Ni、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,晶胞边长为apm,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3.。
【答案】15 ![]() 2、4 N>C>H sp2 离子晶体 4 > 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高
2、4 N>C>H sp2 离子晶体 4 > 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高 ![]() ×1030
×1030
【解析】
(1)铁为26号元素,基态铁原子核外电子排布式为:1s22s22p63s23p63d64s2,其核外有 26种不同运动状态的电子,有1s、2s、 3s、 4s、 2p、 3p、 3d共15种不同空间运动状态的电子;铁、钴、镍的价电子排布式分别为3d64s2、3d74s2、 3d84s2,基态原子核外未成对电子数最少的是Ni,价层电子的电子排布图为![]() ;
;
答案为:15; ![]() ;
;
(2)含有孤对电子的N原子与Co通过配位键结合,形成配位键后有4对共用电子对,形成3对共用电子对的N原子形成普通的共价键, 1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合;酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;根据分子结构简式,其中碳原子在苯环上或形成碳碳双键,因此碳原子为sp2杂化。答案为:2、4;N>C>H;sp2 ;
(3)离子晶体固体中离子不能自由移动而不能导电,而熔融状态下可以电离出自由移动的离子可以导电;由高铁酸钾晶体固体下不导电,熔融状态、水溶液均可导电可知,该晶体为离子晶体;配合物Fe(CO)的中心原子为Fe,其价电子数为8,每个配体是供的电子数为2 ,则可得等式8+2x=16,解得x=4;
答案为:离子晶体; 4;
(4)NiO、 FeO的晶体结构类型均与NaCI相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO;
答案为:>;相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高;
(5)根据晶胞结构图和均摊法可知,晶胞中O原子数为6×![]() =3,Ni原子数为8×
=3,Ni原子数为8×![]() =1, Cr原子为1 ,则化学式为NiCrO3,晶胞变长为a pm,阿伏伽德罗常数值为NA ,则有
=1, Cr原子为1 ,则化学式为NiCrO3,晶胞变长为a pm,阿伏伽德罗常数值为NA ,则有![]() ,则晶体的密度
,则晶体的密度![]()
答案为:![]() ×1030;
×1030;