题目内容
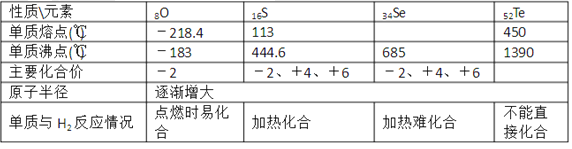
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲烷燃料电池采用铂作电极催化剂,用KOH作为电池中的电解液,其工作原理的示意图如下:
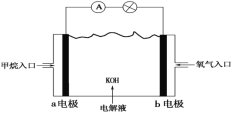
请回答下列问题:
(1)甲烷燃料电池的能量转化主要形式是__________________。
(2)Pt(a)电极是电池的________极,电极反应式为________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为________________。
(3)电池的总反应方程式为_______________________________。
(4)如果该电池工作时电路中通过4 mol电子,则消耗的CH4有________mol。
【答案】化学能转化为电能 负 CH4-8e-+10OH-=CO![]() +7H2O 还原 2O2+8e-+4H2O=8OH- CH4+2OH-+2O2=CO
+7H2O 还原 2O2+8e-+4H2O=8OH- CH4+2OH-+2O2=CO![]() +3H2O 0.5
+3H2O 0.5
【解析】
甲烷燃料电池将化学能转化为电能,通入甲烷的一极为负极发生氧化反应,通入氧气的一极为正极发生还原反应。
(1)甲烷燃料电池的能量转化主要形式是化学能转化为电能。
(2)燃料电池中,电解质溶液呈碱性,所以通燃料的a为负极,燃料失电子发生氧化反应,所以a电极反应式为CH4-8e-+10OH-=![]() +7H2O,Pt(b)电极为正极,发生还原反应,电极反应式为2O2+8e-+4H2O=8OH-。
+7H2O,Pt(b)电极为正极,发生还原反应,电极反应式为2O2+8e-+4H2O=8OH-。
(3)正负极电极反应式相加即得电池总反应式为CH4+2OH-+2O2=![]() +3H2O。
+3H2O。
(4)根据电极反应式CH4-8e-+10OH-=![]() +7H2O,每反应1molCH4,转移8mol电子,则电路中通过4 mol电子,则消耗的CH40.5mol。
+7H2O,每反应1molCH4,转移8mol电子,则电路中通过4 mol电子,则消耗的CH40.5mol。

练习册系列答案
相关题目