题目内容
3.下列实验操作中可行的是( )| A. | 用溴水鉴别苯、四氯化碳、苯乙烯 | |
| B. | 除去苯中少量苯酚,先加浓溴水,再过滤 | |
| C. | 用酸性高锰酸钾溶液洗气,可以除去乙烷气体中乙烯 | |
| D. | 除去乙酸乙酯中的乙酸和乙醇可用氢氧化钠溶液洗涤,再分液 |
分析 A.溴水能与苯乙烯发生加成反应,苯、四氯化碳不溶于水,二者密度不同;
B.三溴苯酚溶于苯中;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳;
D.乙酸乙酯与氢氧化钠反应.
解答 解:A.溴水能与苯乙烯发生加成反应使其褪色,苯、四氯化碳不溶于水,苯的密度比水小,色层在上层,四氯化碳的密度比水大,色层在下层,可鉴别,故A正确;
B.苯酚与溴发生取代反应生成三溴苯酚,三溴苯酚溶于苯中,应用氢氧化钠溶液除杂,故B错误;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,乙烷和酸性高锰酸钾溶液不反应,所以除去杂质又引进新的杂质,用溴水除去乙烯,故C错误;
D.乙酸乙酯与氢氧化钠反应,应用饱和碳酸钠溶液除杂,故D错误.
故选A.
点评 本题综合考查化学实验方案的评价,侧重于物质的检验和分离的考查,题目难度不大,注意把握相关实验的注意事项以及相关物质的性质.

练习册系列答案
相关题目
8.有五瓶溶液分别是:
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
| A. | ⑤>④>③>②>① | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ①>②>③>④>⑤ |
14.已知由石墨制备金刚石的反应为:C(石墨)$\frac{\underline{\;一定条件\;}}{\;}$C(金刚石);△H>0,则下列两个反应中:C(石墨)+O2(g)═CO2(g);△H=a kJ/mol,C(金刚石)+O2(g)═CO2(g);△H=b kJ/mol,a与b的关系为( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
11.化学与社会生活密切相关,下列说法正确的是( )
| A. | 臭氧、乙醇溶液均可用于消毒杀菌且原理完全相同 | |
| B. | 半导体材料和光纤制品都是以硅为基本原料生产的 | |
| C. | 煤的干馏和石油的分馏均属化学变化 | |
| D. | 亚硝酸盐、二氧化硫均可以用作食品的防腐剂 |
18. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
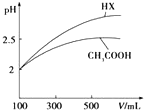
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
15.下列物质互为同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | CH3COOH和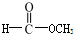 | C. | O2和O3 | D. | CH2=CH2和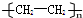 |
12.能正确表示下列反应的离子方程式是( )
| A. | 烧碱溶液中通入过量二氧化硫 2OH-+SO2═SO32-+H2O | |
| B. | 在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液 NH4++H++2OH-═NH3•H2O+H2O | |
| C. | 硫酸铁的酸性溶液中通入足量硫化氢 2Fe3++H2S═2Fe2++S↓+2H+ | |
| D. | 铜与浓硝酸:Cu+2H++2NO3-═Cu2++2NO2↑+H2O |

 .
.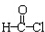 +CH3CH2OH→
+CH3CH2OH→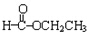 +HCl
+HCl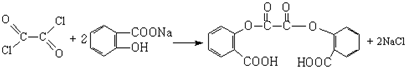
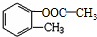 .
. 、
、 等、
等、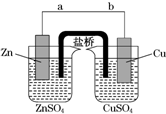 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: