题目内容
7.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2?N2O4).(1)硝酸在该反应中体现的性质有氧化性、酸性.
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O.
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是0.008NA,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是0.012mol,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为44.8 mL;所得溶液(假设溶质不扩散)的物质的量浓度是$\frac{1}{22.4}$mol/L(或0.0446 mol•L-1).
分析 (1)反应中氮元素化合价由+5价降低为+2、+4价,体现硝酸氧化性,同时生成硝酸盐,硝酸体现酸性;
(2)铜失去2个电子形成Cu2+,失去的电子物质的量是铜的2倍,据此计算,根据电子转移守恒计算NO、NO2的物质的量,根据铜元素守恒计算硝酸铜的物质的量,根据氮元素守恒可知参加反应的硝酸的物质的量n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据方程式4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3,计算需要通入O2的物质的量,生成硝酸的物质的量,根据V=cVm计算氧气体积,溶液体积等于一氧化氮与二氧化氮的体积之和,根据c=$\frac{n}{V}$计算硝酸浓度;
(3)令铜为3mol,则HNO3为10mol,根据铜元素守恒可知,生成硝酸铜3mol,所以氧化剂作用的硝酸为10mol-6mol=4mol,令生成NO为xmol,则生成NO2为(4-x)mol,利用电子转移守恒列方程计算x值,据此书写离子方程式.
解答 解:(1)反应中氮元素化合价由+5价降低为+2、+4价,体现硝酸氧化性,同时生成硝酸盐,硝酸体现酸性.
故答案为:氧化性、酸性;
(2)令铜为3mol,则HNO3为10mol,根据铜元素守恒可知,生成硝酸铜3mol,所以氧化剂作用的硝酸为10mol-6mol=4mol,令生成NO为xmol,则生成NO2为(4-x)mol,根据电子转移守恒可知,3x+(4-x)×1=3×2,解得x=1,即生成NO为1mol,则生成NO2为3mol,反应离子方程式为3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O.
故答案为:3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O;
(3)铜失去2个电子形成Cu2+,失去的电子物质的量是铜的2倍,0.004molCu被硝酸完全溶解后,Cu失去的电子数是0.004mol×2×NAmol-1=0.008NA;根据铜元素守恒,n[Cu(NO3)2]=n(Cu)=0.004mol,令NO、NO2的物质的量为ymol,根据电子转移守恒有3y+y=0.004×2,解得y=0.002,根据氮元素守恒可知,参加反应的硝酸的物质的量:n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=0.004mol×2+0.002mol+0.002mol=0.012mol;根据方程式4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3可知,需要通入O2的物质的量为:0.002mol×$\frac{1}{4}$+0.002mol×$\frac{3}{4}$=0.002mol,生成硝酸的物质的量为0.002mol+0.002mol=0.004mol,所以需要氧气的体积为0.002mol×22.4L/mol=0.0448L=44.8ml;溶液体积等于一氧化氮与二氧化氮的体积之和,所以溶液的体积为0.004mol×22.4L/mol=0.004×22.4L,所得溶液的物质的量浓度是$\frac{0.004mol}{0.004×22.4L}$=$\frac{1}{22.4}$mol/L.
故答案为:0.008NA;0.012mol;44.8mL;$\frac{1}{22.4}$mol/L(或0.0446 mol•L-1).
点评 本题考查反应方程式的有关计算,难度中等,(2)中离子方程式的书写关键是NO、NO2的物质的量的确定,注意氧化还原反应原理的灵活应用是关键.

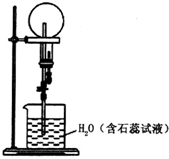 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )| A. | NH3和HCl分别形成蓝色、红色喷泉 | |
| B. | 制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
| A. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| B. | 将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快 | |
| C. | 将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 | |
| D. | 两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同 |
| 序列 | 参加反应的物质 | 生成物 |
| ① | Cl2、FeBr2 | FeCl3、FeBr3 |
| ② | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |
| ③ | MnO4- … | Cl2、Mn2+ … |
| A. | 第①组反应中Cl2与 FeBr2的物质的量之比为1:2 | |
| B. | 第②组反应的其余产物为H2O和 O2 | |
| C. | 氧化性由强到弱顺序MnO4->Cl2>Fe3+>Br2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
| A. | 石油 | B. | 食醋 | C. | 液态氧 | D. | 水泥砂浆 |
| A. | ①④⑤⑥ | B. | ①③⑤⑥ | C. | ①④⑤ | D. | ②③④ |
| A. | CO、SO2均属酸性氧化物 | |
| B. | 凡能电离出H+的化合物均属于酸 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 电解质一定是化合物,非电解质可以是单质也可以是混合物 |
| A. | 该反应是置换反应 | |
| B. | Cl2是氧化剂 | |
| C. | Fe(OH)3发生还原反应 | |
| D. | 该反应每转移6mol电子,消耗3molCl2 |