��Ŀ����
����Ŀ��������ѧ֪ʶ��������⣺
��1��I������п�̸ɵ�ص��ܷ�ӦΪZn+2MnO2+2H2O=2MnOOH+Zn��OH��2 �� �õ���У����������� �� ������ӦʽΪ ��
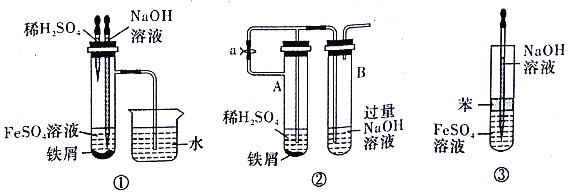
��2�����ԷϾ�п�̸ɵ�ش����õ��Ļ����Ϊԭ���Ʊ���п���������Ҫ������ͼ��ʾ��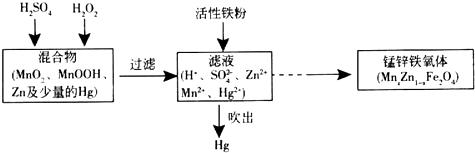
��ش��������⣺
a.MnxZn1��xFe2O4����Ԫ�ػ��ϼ�Ϊ+3������Ԫ�صĻ��ϼ�Ϊ ��
b.�������۳���ʱ�����۵��������������������ԭ��������
c.�������Ե���Ϊ����������Һ�У�������������KMnO4��Һ�������ն�ʵ�ֵģ��ں����²�ͬpHʱ��KMnO4��Һ��Hg�ĵ�λʱ��ȥ���ʼ���Ҫ������ͼ1��ʾ��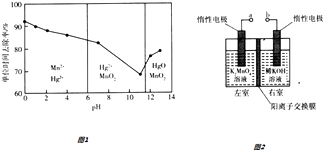
��д��pH=2ʱKMnO4��Һ���չ����������ӷ���ʽ ��
����ǿ���Ի����й��ĵ�λʱ��ȥ���ʸߣ���ԭ���������Ũ������ʹKMnO4����Һ����������ǿ�⣬�������� ��
d.�ö��Ե缫���K2MnO4��Һ�Ʊ�KMnO4��װ����ͼ2��ʾ��
��aӦ��ֱ����Դ�������������������
����֪25�棬������Һ�������Ϊ100mL�����һ��ʱ���������Һ��pH��10��Ϊ14���������Ͽ��Ƶ�mol KMnO4 ��������Һ��������¶ȱ仯����
���𰸡�
��1��Zn��MnO2+H2O+e���TMnOOH+OH��
��2��+2����ԭ����5Hg+2MnO4��+16H+�T2Mn2++5Hg2++8H2O��Mn2+�Է�Ӧ������ã���λʱ����ȥ���ʸߣ�����0.1
���������⣺��1��I������п�̸ɵ�ص��ܷ�ӦΪZn+2MnO2+2H2O�T2MnOOH+Zn��OH��2 �� ԭ����и�������������Ӧ������������Zn���缫��ӦʽΪ��Zn+2OH����2e���TZn��OH��2���ܷ�Ӧʽ��ȥ������Ӧʽ�ɵ�������Ӧʽ����������ӦʽΪ��MnO2+H2O+e���TMnOOH+OH�� �� ���Դ��ǣ�Zn��MnO2+H2O+e���TMnOOH+OH������2����a.MnxZn1��xFe2O4����Ԫ�ػ��ϼ�Ϊ+3�����ݻ��ϼ۴�����Ϊ0����֪��Ԫ�صĻ��ϼ�Ϊ+2�ۣ�
���Դ��ǣ�+2��b.������֪�������۳���ʱ��Hg2+����ԭΪHg�����۵������ǻ�ԭ����
���Դ��ǣ���ԭ����c.�ٸ������ͼ��֪pH=2ʱKMnO4��Һ���չ���������Mn2+��Hg2+ �� ��Ӧ�����ӷ���ʽΪ��5Hg+2MnO4��+16H+�T2Mn2++5Hg2++8H2O��
���Դ��ǣ�5Hg+2MnO4��+16H+�T2Mn2++5Hg2++8H2O��
����ǿ���Ի����й��ĵ�λʱ��ȥ���ʸߣ���ԭ���������Ũ������ʹKMnO4��Һ����������ǿ�⣬�����������ɵ�Mn2+�Է�Ӧ������ã���λʱ����ȥ���ʸߣ�
���Դ��ǣ�Mn2+�Է�Ӧ������ã���λʱ����ȥ���ʸߣ�d.������K2MnO4����������Ӧ����KMnO4 �� �����缫Ϊ���ص�������aӦ��ֱ����Դ��������
���Դ��ǣ�����
�ڵ�������������ӦΪMnO ![]() ��e���TMnO4�� �� ������ӦΪ2H2O+2e���TH2��+2OH�� �� ��֪25�棬������Һ�������Ϊ100mL�����һ��ʱ���������Һ��pH��10��Ϊ14����������������Ũ��Ϊ1mol/L��������OH�������ʵ���Լ��Ϊ0.1L��1mol/L=0.1mol���ɵ���ת���غ��֪�������Ͽ��Ƶ�0.1mol KMnO4 ��
��e���TMnO4�� �� ������ӦΪ2H2O+2e���TH2��+2OH�� �� ��֪25�棬������Һ�������Ϊ100mL�����һ��ʱ���������Һ��pH��10��Ϊ14����������������Ũ��Ϊ1mol/L��������OH�������ʵ���Լ��Ϊ0.1L��1mol/L=0.1mol���ɵ���ת���غ��֪�������Ͽ��Ƶ�0.1mol KMnO4 ��
���Դ��ǣ�0.1mol��

 ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д�����Ŀ��Ŀǰ���ܽ��ȶ����ڵ��ȵ���������Cl2O��ClO2��Cl2O7�ȡ��й����ݼ��±���
��ѧʽ | Cl2O | ClO2 | Cl2O7 |
�е�/�� | 3.8 | 11.0 | 82.0 |
��ش��������⣺
(1)���¡���ѹ�£������������������������______________��
(2)Cl2O7�����������������ˮ��Ӧ�����ӷ���ʽ____________________________��
(3)ClO2��һ�ֳ��õ����������ҹ���2000��������ClO2��������������ˮ�����������ڶ�ˮ����ʱ��ClO2���ɽ�ˮ�е�Fe2����Mn2����ת����Fe(OH)3��MnO2���������ȥ��˵��ClO2����_____________�ԡ�
(4)��ҵ�Ͽ��������з�Ӧ�Ʊ�ClO2��2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4�����õ����ŷ�
��ʾ���÷�Ӧ����ת�Ƶķ������Ŀ______________��
(5)��ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��
NaClO3+ HCl��Ũ��- ClO2��+ Cl2��+ H2O+ NaCl��
����ƽ����ʽ��______________��
��Ũ�����ڷ�Ӧ����ʾ������������__________________������ţ���
A����ԭ�� B�������� C������
����������Ӧ�в���0.1molClO2����ת�Ƶĵ�����Ϊ___________��