题目内容
【题目】某学习小组在实验室通过6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2制备ClO2,并将其转化为便于运输和储存的NaClO2固体,实验装置如图所示。(已知ClO2沸点为10℃,浓度较高时易发生爆炸)下列说法正确的是
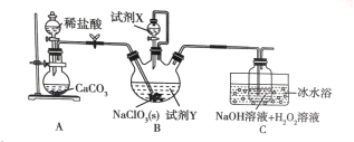
A.试剂X是甲醇
B.B中开始反应后立即停止通二氧化碳
C.此实验可以不用冰水浴
D.C中发生的反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2
【答案】D
【解析】
A. 根据装置图和方程式6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2可知X是硫酸,A项错误;
B. ClO2浓度较高时易发生爆炸,所以反应中不能停止通二氧化碳,B项错误;
C. ClO2沸点为10℃,冰水浴可以使其液化,使反应更加充分,C项错误;
D. C中反应将ClO2转化为NaClO2,反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,D项正确;
答案选D。

【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
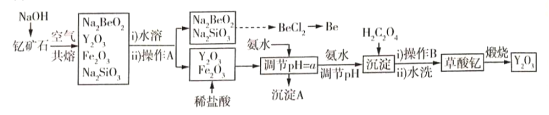
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。
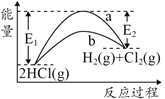
【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1