题目内容
2.把1molX气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)═nZ(g)+2W(g),2min末生成0.2molW,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L•min),试计算:(1)前2min内,用X表示的平均反应速率;
(2)2min末时Y的转化率;
(3)化学方程式中Z的化学计量数n.
分析 2min末生成0.2molW,由方程式可知,消耗的X为0.3mol,消耗的Y为0.1mol.
(1)根据v=$\frac{△c}{△t}$计算v(X);
(2)Y的转化率=$\frac{反应的Y物质的量}{Y起始物质的量}$×100%;
(3)根据速率之比等于化学计量数之比计算n的值.
解答 解:2min末生成0.2molW,由方程式可知,消耗的X为0.2mol×$\frac{3}{2}$=0.3mol,消耗的Y为0.2mol×$\frac{1}{2}$=0.1mol.
(1)则前2min内,v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075 mol/(L.min)
答:前2min内,用X表示的平均反应速率0.075 mol/(L.min);
(2)Y的转化率为$\frac{0.1mol}{0.5mol}$×100%=20%,
答:Y的转化率为20%;
(3)速率之比等于化学计量数之比,0.1mol/(L•min):0.075mol/(L•min)=n:3,解得n=4,
答:n的值为4.
点评 本题考查化学平衡计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
18.设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积为22.4 L | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02 NA | |
| D. | 标准状况下,22.4L 乙醇含有的分子数为NA |
10.取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下反应分别达到平衡,测得N2O4和HI的分解率分别为 a(A)和a(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为a′(A)和a′(B).下列判断一定正确的是( )
| A. | a (A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a (B)=a′(B) | ||
| C. | a (A)<a′(A) a (B)=a′(B) | D. | a (A)=a(A) a (B)>a′(B) |
17.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
②该反应为吸(填“吸”或“放”)热反应,实验2条件下平衡常数K=$\frac{1}{6}$.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol.
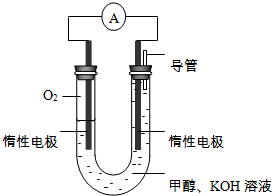
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为O2+2H2O+4e-=4OH-.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O.
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).②该反应为吸(填“吸”或“放”)热反应,实验2条件下平衡常数K=$\frac{1}{6}$.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol.
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为O2+2H2O+4e-=4OH-.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O.
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
12.由CH3CH2Cl合成HOCH2CH2OH 的反应类型有:①取代(水解)反应 ②加成反应③消去反应④氧化反应.按反应的先后顺序最合理的反应组合是( )
| A. | ①② | B. | ①③② | C. | ③②① | D. | ③②①④ |
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
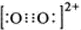 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.