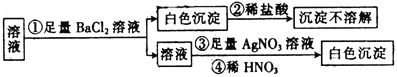
题目内容
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
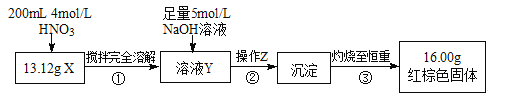
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
【答案】Fe+Cu2+=Fe2++Cu Fe和Fe3O4 过滤 Fe :0.11mol Fe3O4:0.03mol 1
【解析】
I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应,离子方程式为Fe+Cu2+=Fe2++Cu;(2)铁能和盐酸反应生成气体,且铁和铜离子发生置换反应生成红色的铜,据此现象判断存在铁;Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,据此判断Fe3O4的存在.故黑色粉末X为Fe3O4和Fe的混合物;
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤;
(2)红棕色固体为氧化铁,16g氧化铁中含有铁原子的物质的量为16g÷160g/mol×2=0.2mol,设13.12g混合固体中铁的物质的量为xmol,Fe3O4的物质的量为ymol,则
①x+3y=0.2mol②56x+232y="13.12" 两式联立求得x=0.11mol,y=0.03mol,故答案为Fe:0.11mol、Fe3O4:0.03mol;(3)通过(2)中计算可知铁离子的物质的量为0.2mol,因此c(Fe3+)=0.2mol/0.2L=1mol/L。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案