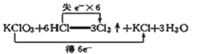
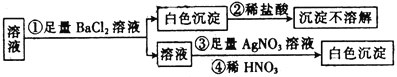
题目内容
【题目】(1)在配制氯化亚铁溶液时要加入一定量的盐酸,目的是______________________;还要加入少量铁粉,目的是_______________________。(以上用相应的离子方程式解释)
(2)把下列溶液蒸干并灼烧,用所得物质的化学式填空:Na2CO3溶液___________; NaClO溶液___________; AlCl3溶液____________。
【答案】促进水解反应Fe2++2H2O![]() Fe(OH)2+2H+逆向移动,达到抑制Fe2+水解的目的 防止Fe2+被氧化,发生的离子反应为2Fe3++Fe=3Fe2+ Na2CO3 NaCl Al2O3
Fe(OH)2+2H+逆向移动,达到抑制Fe2+水解的目的 防止Fe2+被氧化,发生的离子反应为2Fe3++Fe=3Fe2+ Na2CO3 NaCl Al2O3
【解析】
(1)配制FeCl2溶液的过程中要防Fe2+的水解和氧化;
(2)易水解的离子在加热的过程中会促进水解程度增大,结合水解产物分析判断。
(1) Fe2+在水溶液中易水解,发生的水解反应式为,Fe2++2H2O![]() Fe(OH)2+2H+,则在配制氯化亚铁溶液时要加入一定量的盐酸,可抑制Fe2+水解;在FeC12液中需加入少量铁粉,其目的是防止Fe2+被氧化,发生的离子反应为2Fe3++Fe=3Fe2+;
Fe(OH)2+2H+,则在配制氯化亚铁溶液时要加入一定量的盐酸,可抑制Fe2+水解;在FeC12液中需加入少量铁粉,其目的是防止Fe2+被氧化,发生的离子反应为2Fe3++Fe=3Fe2+;
(2) Na2CO3溶液中存在CO32-+H2O![]() HCO3-+OH-,加热促进水解,溶液中NaHCO3和NaOH的浓度增大,两者继续反应生成Na2CO3和水,则最终蒸干并灼烧得到固体为Na2CO3;NaClO溶液中存在水解反应NaClO+H2O
HCO3-+OH-,加热促进水解,溶液中NaHCO3和NaOH的浓度增大,两者继续反应生成Na2CO3和水,则最终蒸干并灼烧得到固体为Na2CO3;NaClO溶液中存在水解反应NaClO+H2O![]() NaOH+HClO,加热促进水解平衡正向移动,且加热过程中HClO分解生成HCl和O2,其中HCl和NaOH发生中和反应生成NaCl,则加热蒸干、灼烧最终所得固体为NaCl;氯化铝水溶液中水解生成氢氧化铝和盐酸,反应的离子方程式为Al3++3H2OAl(OH)3+3H+;溶液蒸干,氯化氢挥发促进水解正向进行得到氢氧化铝,再灼烧得到氧化铝,反应的化学方程式为2Al(OH)3
NaOH+HClO,加热促进水解平衡正向移动,且加热过程中HClO分解生成HCl和O2,其中HCl和NaOH发生中和反应生成NaCl,则加热蒸干、灼烧最终所得固体为NaCl;氯化铝水溶液中水解生成氢氧化铝和盐酸,反应的离子方程式为Al3++3H2OAl(OH)3+3H+;溶液蒸干,氯化氢挥发促进水解正向进行得到氢氧化铝,再灼烧得到氧化铝,反应的化学方程式为2Al(OH)3 ![]() Al2O3+3H2O。
Al2O3+3H2O。

【题目】A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素。A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能。E是第四期第IB族元素,回答下列问题:
A | B | |
D |
⑴E原子的基态电子排布式 ______;
⑵A、B、C三种元素的第I电离能由大到小的顺序是 ______;
⑶D能形成多种价态的含氧酸,其酸性由强到弱的顺序为 ______;
⑷已知金属C单质的晶胞为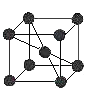 ,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
⑸向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为![]() 写真实符号
写真实符号![]() ______。
______。