题目内容
【题目】消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) △H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
N2(g)+CO2(g) △H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10 min 内,N2的平均反应速率 υ(N2)=________,T1℃时,该反应的平衡常数 K=_____。
②30 min 后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是____________ (填字母)
a. 加入一定量的活性炭 b. 改变反应体系的温度 c. 缩小容器的体积 d. 通入一定量的NO
③若30 min后升高温度至 T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的△H______0(填“>” 、 “ =” 、或“<” )
(2)NH3催化还原法:原理如图所示

①若烟气中 c(NO2): c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为_____ 。
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为___;使用Mn作催化剂时,脱氮率b~a段呈现如图变化的可能原因是___。
(3)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。
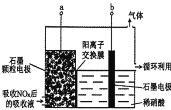
①图中b应连接电源的_________ (填“正极”或“负极”)。
②将石墨电极设置成颗粒状的目是_____________________。
③阳极的电极反应式为___________________。
【答案】0.03mol·L-1·min-1 4 c d < 2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH=-455.2kJ/mol Mn,200℃ b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高 负极 增大吸收液与电极的接触面积,提高电解反应的效率 H2O+HNO2-2e-=NO3-+3H+(或NO2-+H2O-2e-=NO3-+2H+)
2N2(g)+3H2O(g) ΔH=-455.2kJ/mol Mn,200℃ b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高 负极 增大吸收液与电极的接触面积,提高电解反应的效率 H2O+HNO2-2e-=NO3-+3H+(或NO2-+H2O-2e-=NO3-+2H+)
【解析】
(1)①由图可得![]() ,由同一反应中,物质的速率之比等于化学方程式中相应的化学计量数之比,可知
,由同一反应中,物质的速率之比等于化学方程式中相应的化学计量数之比,可知![]() ;由题给表格可知,20min时N2的浓度为0.40mol/L,则NO的浓度为1.00mol/L-0.40mol/L×2=0.20mol/L,30min时NO的浓度为0.20mol/L,则20~30min时反应保持平衡状态,此时平衡常数K=
;由题给表格可知,20min时N2的浓度为0.40mol/L,则NO的浓度为1.00mol/L-0.40mol/L×2=0.20mol/L,30min时NO的浓度为0.20mol/L,则20~30min时反应保持平衡状态,此时平衡常数K=![]() 。故答案为:0.03mol·L-1·min-1;4;
。故答案为:0.03mol·L-1·min-1;4;
②分析表中数据,30min后若只改变一个条件,反应重新达到平衡时各物质的浓度均为原平衡的1.5倍,据此进行
a.活性炭为固体,加入一定量的活性炭,平衡不移动,a项不可能;
b.改变体系温度,平衡会移动,但不会导致NO、N2、CO2的浓度均增大,b项不可能;
c.缩小容器体积,反应前后是气体体积不变的反应,平衡不移动,但物质的浓度都变大,c项可能;
d.通入一定量的NO,平衡向正反应方向移动,由于反应前后是气体体积不变的反应,达平衡后NO、N2、CO2的浓度均成比例增大,d项可能;
答案为:cd;
③设T2℃后重新达到平衡时,NO的浓度为7x,则此时的平衡常数K2=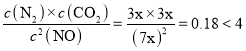 ,说明升高温度反应向逆反应方向移动,则反应的△H<0,故答案为:<;
,说明升高温度反应向逆反应方向移动,则反应的△H<0,故答案为:<;
(2)①由图知NH3催化还原法中,NH3被NO、NO2氧化成N2,NO、NO2做氧化剂,故反应方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g),每2molNH3反应过程中转移6mol电子,根据“反应过程中转移1.5mol电子时放出热量为113.8kJ”可知,转移6mol电子,放出热量=
2N2(g)+3H2O(g),每2molNH3反应过程中转移6mol电子,根据“反应过程中转移1.5mol电子时放出热量为113.8kJ”可知,转移6mol电子,放出热量=![]() ,故该脱氮反应的热化学方程式为:2NH3(g)+NO(g)+NO2(g)
,故该脱氮反应的热化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH=-455.2kJ/mol;答案为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g) ΔH=-455.2kJ/mol;答案为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH=-455.2kJ/mol;
2N2(g)+3H2O(g) ΔH=-455.2kJ/mol;
②由图乙可知,Mn作催化剂,在200℃时的脱氮率最高。Cr作催化剂,在450℃左右脱氮率最高,相比Mn做催化剂更节约能源,由此可知工业使用的最佳催化剂和相应温度为Mn,200℃;脱氮率b~a段呈现如图变化的可能原因是开始温度较低,催化剂的活性较低,故脱氮反应速率较慢,随着温度升高,反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高,故答案为:Mn,200℃;b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高;
(3)①由题意可知,在电解槽中亚硝酸发生氧化反应转变为硝酸,则生成气体的反应为还原反应,即b电极处发生还原反应,根据电解池原理,可知发生还原反应的为电解池的阴极,与电源的负极相连,故答案为:负极;
②增大反应物的接触面积能加快反应速率,故石墨电极为颗粒状,可增大接触面积,提高电解效率,答案为:增大吸收液与电极的接触面积,提高电解反应的效率;
③电极的阳极为氧化反应,即亚硝酸被氧化成硝酸,故电极反应方程式为:H2O+HNO2-2e-=NO3-+3H+(或NO2-+H2O-2e-=NO3-+2H+),答案为:H2O+HNO2-2e-=NO3-+3H+(或NO2-+H2O-2e-=NO3-+2H+)。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D