题目内容
【题目】高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图1: 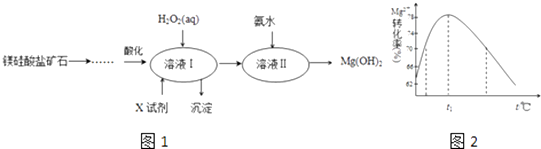
已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)向溶液Ⅰ中加入X的作用是 .
(2)向溶液Ⅰ中加入的两种试剂先后顺序是(填化学式).
(3)加入H2O2溶液反应的离子方程式是 .
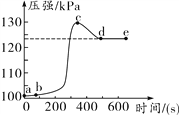
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是;t1后Mg2+转化率下降的原因是(用化学方程式表示) .
②向溶液Ⅱ中加入氨水反应的离子方程式是 .
【答案】
(1)调节溶液pH
(2)H2O2、MgO
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
(4)升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;NH3?H2O ![]() NH3↑+H2O;Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
NH3↑+H2O;Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
【解析】解:液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子,根据题中提供的各种金属离子沉淀的pH值可知,加入双氧水可以将亚铁离子氧化成铁离子,再加入试剂X主要作用是调节溶液pH值,使铁离子沉淀,可以加氧化镁或氢氧化镁等,过滤后在滤液中加入氨水使溶液中镁离子沉淀,得氢氧化镁沉淀,由于要通过使铁离子沉淀的方法除去铁,所以要先氧化再沉淀,根据Mg2+转化率随温度t的变化示意图可知,由于氨水与镁离子反应生成氢氧化镁的反应是吸热反应,所以升高温度,镁离子的转化率增大,但随着温度的升高,氨气在水中的溶解度减小,氨水的浓度减小,会导致Mg2+转化率减小.
(1.)根据上面的分析可知,向溶液Ⅰ中加入X的作用是调节溶液pH,所以答案是:调节溶液pH;
(2.)根据上面的分析可知,要先氧化再沉淀,所以向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO,所以答案是:H2O2、MgO;
(3.)根据上面的分析可知,加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4.)①根据上面的分析可知,t1前Mg2+转化率增大的原因是 升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是氨气在水中的溶解度减小,氨水的浓度减小,反应的方程式为 NH3H2O ![]() NH3↑+H2O,所以答案是:升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;NH3H2O
NH3↑+H2O,所以答案是:升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;NH3H2O ![]() NH3↑+H2O;
NH3↑+H2O;
②向溶液Ⅱ中加入氨水与镁离子反应生成氢氧化镁沉淀,反应的离子方程式是 Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ ,
所以答案是:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ .

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案