题目内容
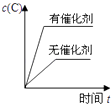
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:H+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:S2-、NO3-、Fe2+、Ag+
【答案】C
【解析】根据题意,当n(HCl)为0到b点应为CO32-和H+反应生成HCO3-的过程,a点中存在的离子是Na+、Cl-、HCO3-和CO32-;b点开始产生气体,对应的离子是Na+、Cl-、HCO3-;c点后不再产生气体,溶液中主要是Na+、Cl-,d点中存在Na+、H+、Cl-;
A、OH-离子不能与溶液中的HCO3-离子共存,A项错误;B、H+不能与HCO3-共存,B项错误;C、可以大量共存,C项正确;D、Ag+不能与Cl-大量共存,H+和NO3-同时存在是具有强氧化性能氧化Fe2+生成Fe3+,氧化S2-离子到高价态的的单质S或SO2,D项错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图1: 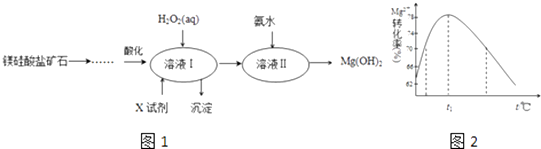
已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)向溶液Ⅰ中加入X的作用是 .
(2)向溶液Ⅰ中加入的两种试剂先后顺序是(填化学式).
(3)加入H2O2溶液反应的离子方程式是 .
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是;t1后Mg2+转化率下降的原因是(用化学方程式表示) .
②向溶液Ⅱ中加入氨水反应的离子方程式是 .