题目内容
15.在不同条件下分别测得反应2SO2+O2?2SO3的化学反应速率,其中表示该反应进行得最快的是( )| A. | v(SO2)=4 mol/(L•min) | B. | v(O2)=3 mol/(L•min) | ||
| C. | v(SO3)=6 mol/(L•min) | D. | v(O2)=6 mol/(L•min) |
分析 由于不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位要保持一致.
解答 解:由于不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,
A.$\frac{v(S{O}_{2})}{2}$=2 mol/(L•min);
B.$\frac{v({O}_{2})}{1}$=1.5 mol/(L•min);
C.$\frac{v(S{O}_{3})}{2}$=3 mol/(L•min);
D.$\frac{v({O}_{2})}{1}$=6 mol/(L•min);
故反应速率D>C>A>B,
故选D.
点评 本题考查化学反应速率快慢比较,难度不大,可以转化为同一物质表示的速率进行比较,但利用比值法可以迅速判断.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
5.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O═Ca(OH)2+2H2↑,下列叙述正确的是( )
| A. | H2O既不是氧化剂也不是还原剂 | B. | Ca(OH)2是氧化产物 | ||
| C. | 生成1molH2转移的电子数为2NA | D. | CaH2是还原剂 |
6.能正确表示下列化学反应的离子方程式的是( )
| A. | 碳酸钠溶于足量盐酸中 Na2CO3+2H+=2Na++CO2↑+H2O | |
| B. | 氧化钠与稀硫酸的反应 Na2O+2H+=2Na++H2O | |
| C. | 氢氧化钡溶液与硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铁片插入稀硫酸溶液中 Fe+2H+=Fe3++H2↑ |
10.氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的 关系如下表:
①写出该反应的平衡常数表达式.K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$.
②试判断K1>K2(填写“>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4 做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.
某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图2所示.
①该燃料电池的负极反应式为N2H4+4OH--4e-=N2↑+4H2O;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图中曲线 I、II所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L
③在t2时所得溶液的pH为1.(假设溶液体积不变)
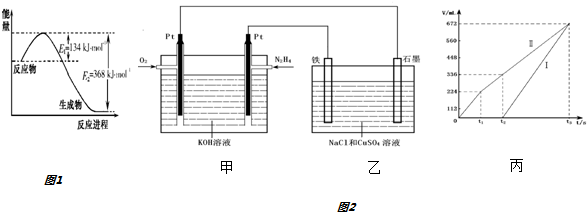
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的 关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4 做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.
某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图2所示.
①该燃料电池的负极反应式为N2H4+4OH--4e-=N2↑+4H2O;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图中曲线 I、II所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L
③在t2时所得溶液的pH为1.(假设溶液体积不变)

20.胃酸过多会导致消化不良和胃痛,可以服用抗酸药来缓解胃部不适,下列各组成物质都属于抗酸药的是( )
| A. | NaHCO3、NaOH、Mg(OH)2 | B. | NaHCO3、Na2CO3、MgCO3 | ||
| C. | NaHCO3、MgCO3、Al(OH)3 | D. | Na2CO3、MgCO3、CaO |
7.关于油脂在人体中的生理功能的理解错误的是( )
| A. | 油脂水解后的产物经氧化为人体提供能量 | |
| B. | 多摄入动物脂肪对人体有害 | |
| C. | 油脂能保持体温,保护内脏器官 | |
| D. | 油脂能促进VB、VC的吸收 |
4.下列物质的电子式书写正确的是( )
| A. |  | B. | 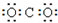 | C. |  | D. | 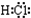 |
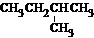
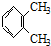 和
和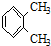
 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下: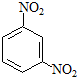 +Na2S2+H2O→
+Na2S2+H2O→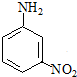 +Na2S2O3
+Na2S2O3