题目内容
20.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )| A. | Na+K+OH-Cl- | B. | Na+Cu2+SO42-NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
分析 A.氢氧根离子与强酸性溶液中的氢离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.四种离子之间不发生反应,且为无色溶液;
D.钡离子、碳酸根离子反应生成碳酸钡沉淀;
解答 解:A.OH-与强酸性溶液中的OH+反应,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.K+ Na+ SO42- Cl-之间不反应,且都是无色离子,在溶液中不能大量共存,故C正确;
D.Ba2+、CO32-之间反应生成碳酸钡沉淀,CO32-与强酸反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目要求的是“可能”共存,还是“一定”共存;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识的能力.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
11.实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )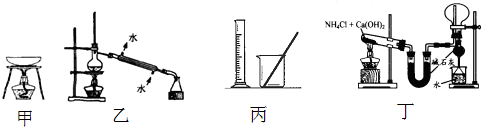

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 用图丙所示仪器配制0.150mol/LNaOH溶液 | |
| D. | 如图丁所示可用于实验室制氨气并收集干燥的氨气 |
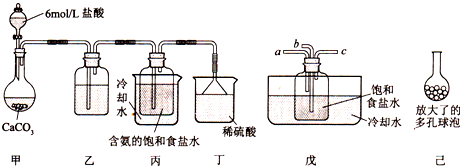
8.解释下列事实的离子方程式或电极反应式不正确的是( )
| A. | 酸性KI淀粉溶液在空气中久置后变蓝:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 铅蓄电池充电时阴极质量减轻:PbSO4+2e-=Pb+SO42- | |
| D. | 明矾与足量Ba(OH)2溶液混合有沉淀出现:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
5.下列叙述正确的是( )
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
 .
.
 .
. .
. .
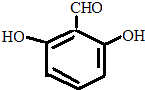
.
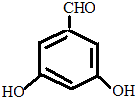
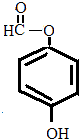 .
.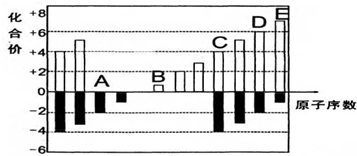
 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: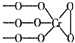 ,则Cr的化合价为+5.
,则Cr的化合价为+5.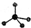 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为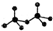 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.