题目内容
【题目】根据题意填空:
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 .
A.C(s)+H2O(g)=CO(g)十H2(g)△H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<O
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为: .
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 . 通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 .
(4)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其燃烧热的热化学方程式为 . 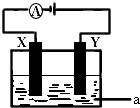
【答案】
(1)C
(2)H2﹣2e﹣+2OH﹣﹣=2H2O
(3)CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;0.4mol;Cu﹣2e﹣=Cu2+
2Cu+O2↑+2H2SO4;0.4mol;Cu﹣2e﹣=Cu2+
(4)B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165kJ?mol﹣1
【解析】解:(1)A.该反应在吸热反应,不能设计成原电池,故A错误;
B.该反应不属于氧化还原反应,不能设计成原电池,故B错误;
C.该反应属于自发进行的放热的氧化还原反应,能设计成原电池,故C正确;
故选C; (2)碱性氢氧燃料电池中,负极上燃料氢气失电子好氢氧根离子反应生成水,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,所以答案是:H2﹣2e﹣+2OH﹣=2H2O;(3)①若X和Y均为惰性电极,a为CuSO4溶液,电解时,X电极上铜离子放电、Y电极上氢氧根离子放电,所以电池反应式为2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;加入0.2molCuO能使溶液恢复原状,说明电解过程中只生成氧气和铜,根据Cu原子守恒得n(CuO)=n(Cu)=0.2mol,根据Cu和转移电子之间的关系知,转移电子的物质的量=0.2mol×2=0.4mol,
2Cu+O2↑+2H2SO4;加入0.2molCuO能使溶液恢复原状,说明电解过程中只生成氧气和铜,根据Cu原子守恒得n(CuO)=n(Cu)=0.2mol,根据Cu和转移电子之间的关系知,转移电子的物质的量=0.2mol×2=0.4mol,
所以答案是:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;0.4mol;
2Cu+O2↑+2H2SO4;0.4mol;
②若X、Y分别为铁和铜,a仍为CuSO4溶液,Y电极上铜失电子发生氧化反应,电极反应式为Cu﹣2e﹣=Cu2+ , 所以答案是:Cu﹣2e﹣=Cu2+;(4)0.2mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出433.0kJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出433.0×5=2165.0kJ的热量,热化学方程式中放热△H<0,所以△H=﹣2165.0kJ/mol,所以该反应的热化学方程式为B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165.0kJ/mol,
所以答案是:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165.0kJ/mol.