��Ŀ����
����Ŀ��50 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
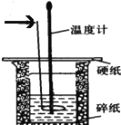
��1����ͷ��ָ����������Ϊ______________________________��
��2����ͼ��ʾʵ��װ�ô�����һ�������������_______________��
��3����ijͬѧʵ���и���60 mL 0.50 mol��L��1ϡ�����50 mL 0.55 mol��L��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_______(���ȡ�����ȡ�)�������к���_______________(���ȡ�����ȡ�)��
��4����ijͬѧ�ø������װ����ʵ�飬��ɲ���к��ȵ���ֵƫ�ͣ�����������ܵ�ԭ����________��
A������ʵ��ĵ������½ϵ�
B������ȡ����ʱ���ӿ̶���
C������ȡ����������Һʱ���ӿ̶���
D����50mL0.55mol/L����������Һȡ����50mL0.55mol/L�İ�ˮ
E������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ���ȥ��������������Һ���¶�
F������Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ�
���𰸡� ���β�������� ���ձ���С�ձ�δ��ƽ ����� ��� ABCDEF
��������������������⿼���к��ȵIJⶨ����������
��1����ͷ��ָ����������Ϊ���β����������
��2�����к��Ȳⶨʵ����Ҫ����������ɢʧ��ͼ��ʵ��װ�õĴ����ǣ����ձ���С�ձ�δ��ƽ��
��3����ijͬѧʵ���и���60mL0.50mol/Lϡ������50mL0.55mol/LNaOH��Һ���з�Ӧ����������H2O���ʵ�������������ų�����������ȡ���Ϊϡ�����NaOH��Һ�ķ�Ӧ��ϡ�����NaOH��Һ�ķ�Ӧ������д��H++OH-=H2O���к���������1molH2O�����������������أ����������к�����ȡ�
��4��A���ʵ��ĵ������½ϵͣ��²������ɢʧ�϶࣬����к�����ֵƫ�ͣ�B�����ȡ����ʱ���ӿ̶��ߣ������������ƫС��n��HCl��ƫС����Ӧ�ų�������ƫ�ͣ�����к�����ֵƫ�ͣ�C�����ȡNaOH��Һʱ���ӿ̶��ߣ�����NaOH��Һƫ����Һ������ƫ�����NaOH������������Ӧ���¶�����ֵƫС������к�����ֵƫ�ͣ�D�����50mL0.55mol/L��ˮ����50mL0.55mol/LNaOH��Һ�����ڰ�ˮΪ����ˮ��Һ������ĵ��������ȹ��̣�����к�����ֵƫ�ͣ�E�����������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ���ȥ����NaOH��Һ���¶ȣ���ʱ�������¶ȼ��ϵ�������NaOH��Ӧ�������ɢʧ������к�����ֵƫ�ͣ�F�����Ͳ�е�NaOH��Һ����С�ձ�ʱ�����ٻ�������ɢʧ�϶࣬����к�����ֵƫ�ͣ�����ɲ�õ��к�����ֵƫ�͵���ABCDEF��

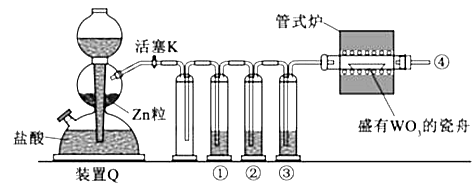
����Ŀ��CH3ClΪ��ɫ���Դ���ζ�����壬�ܶ�Ϊ2.25g/L���۵�Ϊ��24.2�棬��������ˮ���������Ҵ��ͱ������л��ܼ��� ��ʵ������ȡCH3Cl��ԭ����CH3OH+HCl��Ũ�� ![]() CH3Cl+H2O�����岽�����£�
CH3Cl+H2O�����岽�����£�
�ٸ���ZnCl2���壻
�ڳ�ȡ24g��ϸ����ˮZnCl2����ȡ20mLŨ�������Բ����ƿ��ͬʱ��ȡһ�����ļ״������Һ©���У�
�۽���Һ©����ļ״���ε�����ƿ�в����ȣ���ZnCl2��ȫ�ܽ����CH3Cl�����ݳ���������ˮ���ռ���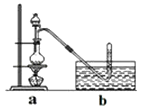
��ش�
��1��ʵ���Ҹ���ZnCl2�����Ƶ���ˮZnCl2�ķ�����
��2����Ӧ�����е�����ƿ�м״�������������٣��״���Ũ��������ʵ���Ũ�Ƚӽ����������� ��
��3��ʵ����Ϊ������ˮ���ռ�CH3Cl��
��4����ij���ϼ��أ�CH4�����е�һ��Hԭ�ӱ�Clԭ��ȡ�������ȶ����ܵ�Ӱ�죬�ɱ�ǿ���������Ը������������������ֻϴ��ƿ���ֱ�ʢ�������Լ��� A.1.5%KMnO4��H+����Һ�� B������ˮ��C.5%Na2SO3��Һ�� D.98%H2SO4
Ϊ֤ʵ��һ���۵Ŀɿ��ԣ��������ѡ����ǡ����ϴ��ƿ����aװ�����ɵ���������ͨ��ϴ��ƿ����ϴ��ƿ��ţ�������۲쵽��֤ʵ�������ϵ���ȷ�ԣ�
��5��д��ϴ��ƿ�з�����Ӧ�����ӷ���ʽ��CԪ�ص���������ΪCO2����
��6�����CH3Cl�Ǵ�������Ⱦ�����ϴ��ƿ֮��Ӧ��һֻʢ��ϴ��ƿ��
��7��ijС��ͬѧȡVmL��CH3Cl��Ⱦ��ˮ������ƿ�У���0.10molL��1����KMnO4��Һ���еζ���ʵ���������������ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.02 | 20.00 | 19.98 |
��һ��ʵ�����ݳ����쳣����������쳣��ԭ�������������ĸ���ţ���
a����ƿϴ����δ���� b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ�����������ƿʱ��Һ�彦�� d���ζ��յ�ʱ���Ӷ�����