题目内容
【题目】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。
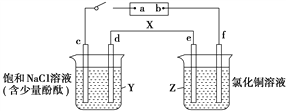
(1)①电源b极为________(填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________极。
③连接Y、Z烧杯线路中,电子流动的方向是d________(填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________。
【答案】 负 阳 ← 2Cl--2e-===Cl2↑ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cu-2e-===Cu2+ 0.02 0.02 mol·L-1·min-1
2NaOH+H2↑+Cl2↑ Cu-2e-===Cu2+ 0.02 0.02 mol·L-1·min-1
【解析】X为直流电源,Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒,接通电路后发现d附近溶液显红色,因为Y中盛有饱和氯化钠溶液(含少量酚酞),所以d附近生成OH-,则d极为电解池阴极,c极为电解池阳极,a为直流电源正极,b为直流电源负极。
(1)①由上面分析可知b为直流电源负极。②Z烧杯中e与原电池正极相连,则e为阳极。③外电路中,电流由正极流出,最后流入负极,因为a为直流电源正极,b为直流电源负极,所以连接Y、Z烧杯线路中,电流方向是从d流向e,电子流向与电流方向相反,则电子流向是从e流向d。
(2)①c极为电解池阳极,电解饱和氯化钠溶液,阳极上Cl-失电子发生氧化反应生成Cl2,电极反应式为:2Cl--2e-=Cl2↑。②Y烧杯中为惰性电极电解饱和氯化钠溶液,其总反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。③Z烧杯中e与电源正极相连,为阳极,Cu作阳极发生氧化反应,电极反应式为Cu-2e-=Cu2+。
2NaOH+H2↑+Cl2↑。③Z烧杯中e与电源正极相连,为阳极,Cu作阳极发生氧化反应,电极反应式为Cu-2e-=Cu2+。
(3)①e极反应为:Cu-2e-=Cu2+,质量减少,f极反应为:Cu2++2e-=Cu,质量增加,根据得失电子守恒,e极减少的质量等于f极增加的质量;因为e、f两极质量差为1.28g,所以e极减少0.64g,物质的量为0.01mol,失去0.02mol电子,f极增加0.64g,物质的量为0.01mol,得到0.02mol电子,故电路中通过的电子为0.02mol。②Y烧杯中阴极反应为:2H2O-2e-=2OH-+H2↑,根据前面的计算,电解2min后,电路中通过0.02mol电子,所以生成0.02molOH-,故电解反应的速率v(OH-)=0.02mol÷0.5L÷2min=0.02molL-1min-1。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案



